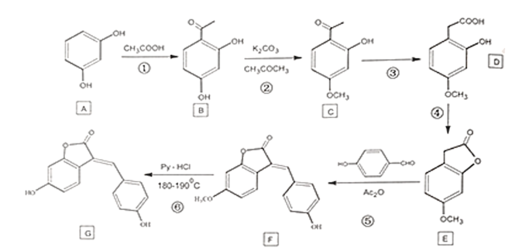
题目内容
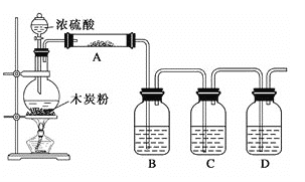
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。
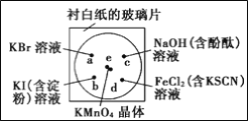
(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
【答案】2 16 2 2 5 8 H2O 8NA b处溶液变蓝色 c处溶液红色褪色 2Fe2++ Cl2 = 2Fe3++ 2Cl- Fe3++ 3SCN- = Fe(SCN)3 KMnO4 > Cl2 > FeCl3
【解析】
高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,此反应原理为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。在此反应中高锰酸钾是氧化剂,盐酸是还原剂,根据高锰酸钾或参加氧化还原反应的盐酸的计量数及化合价变化可判断出转移电子的数目。产物氯气具有氧化性,且易与碱反应,由此解题。
(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,故其配平系数为2、16、2、2、5、8H2O;该反应中氧化剂是高锰酸钾,还原剂是盐酸,根据转移电子数守恒可知,当2mol高锰酸钾参加反应时,转移电子数目=2mol×(7-2)=10mol,此时消耗还原剂的物质的量为10mol,因此当反应中消耗还原剂的物质的量为8mol,则电子转移数目为8NA;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能与氢氧化钠反应生成氯化钠、次氯酸钠和水,使酚酞褪色。因此b处看到的现象是溶液变蓝色,c处看到的现象是溶液红色褪去;
(3)d处 氯气氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以d处反应的离子方程式为2Fe2++ Cl2 = 2Fe3++ 2Cl- 、 Fe3++ 3SCN-= Fe(SCN)3;
(4)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3。

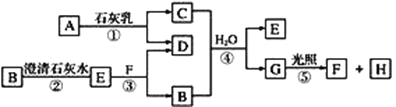
【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。

称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。