题目内容
10.(1)实验室制备氨气的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.检验氨气已经收集满的操作方法是将湿润的红色石蕊试纸靠近集气瓶,若试纸变蓝,说明氨气收集满;.(2)画出硅元素的原子结构示意图
 ,该元素在周期表中的位置为第三周期,第ⅣA族,下列不属于晶体硅的用途的是ACD
,该元素在周期表中的位置为第三周期,第ⅣA族,下列不属于晶体硅的用途的是ACDA.集成电路 B.光导纤维 C.计算机芯片 D.太阳能电池.
分析 (1)实验室用加热氯化铵、氢氧化钙的方法制取氨气;氨气为碱性气体,能够使湿润的红色石蕊试纸变蓝;
(2)硅原子有14个质子,核外有3个电子层,分别容纳2,8,4个电子;周期序数等于电子层数,主族序数等于最外层电子数;硅为良好的半导体材料.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;氨气为碱性气体,能够使湿润的红色石蕊试纸变蓝,将湿润的红色石蕊试纸靠近集气瓶,若试纸变蓝,说明氨气收集满;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;将湿润的红色石蕊试纸靠近集气瓶,若试纸变蓝,说明氨气收集满;
(2)硅原子有14个质子,核外有3个电子层,分别容纳2,8,4个电子.原子结构示意图: ;第三周期,第ⅣA族;硅为良好的半导体材料,能够用来做:集成电路,计算机芯片,太阳能电池,故选:ACD;
;第三周期,第ⅣA族;硅为良好的半导体材料,能够用来做:集成电路,计算机芯片,太阳能电池,故选:ACD;
故答案为: ;该元素在周期表中的位置为:第三周期,第ⅣA族;ACD.
;该元素在周期表中的位置为:第三周期,第ⅣA族;ACD.
点评 本题考查了硅的结构及在周期表中位置,晶体硅的用途,熟悉原子结构与周期表位置关系是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列反应过程会放出热量且既属于氧化还原反应,又属于离子反应的是( )
| A. | 甲烷在氧气中的燃烧反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铝与稀盐酸的反应 |
5.下列物质属于等电子体一组的是( )
| A. | NH3和NH4+ | B. | H2O和CH4 | C. | CO2、NO2 | D. | B3H6N3和C6H6 |
2.有硫酸镁溶液500mL,它的密度是1.20g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
| A. | 硫酸根离子的质量分数是19.2% | B. | 溶质的质量分数是24.0% | ||
| C. | 溶液的物质的量浓度是2.4 mol/L | D. | 溶质和溶剂的物质的量之比是1:40 |
20.下列鉴别方法中不能对二甲醚和乙醇进行鉴别的是( )
| A. | 利用质谱法 | B. | 利用金属钠 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱 |
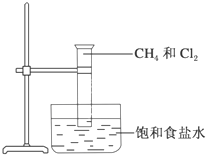 如图是研究甲烷取代反应实验装置图,具体的实验方法是:
如图是研究甲烷取代反应实验装置图,具体的实验方法是:
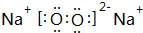 、
、 .
.