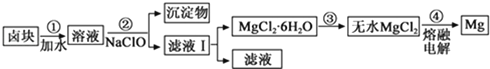
题目内容
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为__________mol。
【答案】(1)b>a>c;
(2)NaCN+CO2+H2O=NaHCO3+HCN;
(3)B、D;
(4)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(5)c(Na+)>c(HC2O4-)>c(H+)> c(C2O42-)> c(OH-);c(OH-)+ c(HC2O4-)+ 2c (C2O42-)= c(H+)+ c(Na+);
(6)0.2。
【解析】
试题分析:(1)电离平衡常数,CH3COOH>H2CO3>HCN,等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa;
(2)NaCN和少量CO2反应生成NaHCO3、HCN,反应方程式为:NaCN+CO2+H2O=NaHCO3+HCN;
(3)将0.02mol/L的HCN与0.01mol/L 的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005molL-1的NaCN、HCN,测得c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),溶液呈碱性,所以HCN的浓度为0.005molL-1,CN-的浓度小于0.005molL-1,
A.根据分析可知,溶液呈碱性,c(H+)<c(OH-),故A错误;B.混合液呈碱性,则c(H+)<c(OH-),故B正确;C.氢氧根离子浓度较小,c(CN-)远远大于c(OH-),故C错误;D.根据物料守恒可知:c(HCN)+c(CN-)=0.01mol/L,故D正确;故答案为BD;
(4)铝离子与碳酸氢根离子混合发生双水解生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(5)草酸氢钠溶液显示酸性,则HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);草酸氢钠溶液中存在的质子守恒为:c(OH-)=c(H+)-c (C2O42-)+c(H2C2O4);
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,标准状况下4.48L二氧化碳的物质的量为:![]() =0.2mol,H2C2O4中C元素的化合价为+3价,二氧化碳分子中C的化合价为+4价,则生成0.2mol二氧化碳转移的电子的物质的量为:0.2mol×(4-3)=0.2mol。
=0.2mol,H2C2O4中C元素的化合价为+3价,二氧化碳分子中C的化合价为+4价,则生成0.2mol二氧化碳转移的电子的物质的量为:0.2mol×(4-3)=0.2mol。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案