��Ŀ����
����Ŀ����ˮ��һ����Ļ�ѧ��Դ���⣬���ú�ˮ���Ի������������Ʒ��
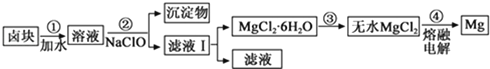
��1���ɺ�ˮɹ���Ƶõ��Ȼ��ƿ������ȼҵ��ԭ�ϣ��������ռ�������������õ�ⷴӦ�����ӷ���ʽΪ ��
��2���������κ����±��ȡ��Ĺ�����������(���ֲ�������������ȥ)��
��±![]() ��Ũ��Br2
��Ũ��Br2![]() ��Һ��
��Һ��![]() Br2
Br2
д��Br2��Na2CO3��Һ��Ӧ�����ӷ���ʽ(��ʾ�����������뻹ԭ�������ʵ���֮��Ϊ1��5) ��
��3����±������ȴ������±�����Ҫ�ɷ���MgCl2�������Fe2+��Fe3+��Mn2+�����ӣ���±��Ϊԭ���Ƶ�þ�Ĺ�����������(���ֲ�������������ȥ)��
��֪�����������������pH���£�
�� �� �� | �� ʼ �� �� | �� �� �� ȫ |
Fe (OH)3 | 2.7 | 3.7 |
Fe (OH)2 | 7.6 | 9.6 |
Mn (OH)2 | 8.3 | 9.8 |
Mg (OH)2 | 9.6 | 11.1 |
���������������pH=9.8����Ŀ���� ��
����NaClO ����Fe2+�õ�Fe (OH)3���������ӷ���ʽ�ǣ� ��
��NaClO���ܳ�ȥ��±�е�����[CO (NH2)2]�������������ʺ��ܲ������ѭ�������ʣ��йط�Ӧԭ��Ϊ��3NaClO+ CO (NH2)2 �T 3NaCl+CO2��+N2��+2H2O �������������ȥ��±�к��е�0.1mol CO (NH2)2ʱ������NaClO g��
���𰸡�
��1��2Cl�D+2H2O![]() Cl2��+H2��+2OH �D
Cl2��+H2��+2OH �D
��2��3Br2+3CO32�D= BrO3�D+5Br�D+3CO2�� ��
��3����ʹ��Һ�к��е�Fe2+��Fe3+��Mn2+������ȫ���ɳ�������ȥ ��ClO�D+2Fe2++5H2O=2 Fe (OH)3��+Cl�D+4H+ �� 22.35
��������
�����������1������Ȼ�����Һ�����������������ƺ������������������������ⷴӦ�����ӷ���ʽ��2Cl-+2H2O![]() Cl2��+H2��+2OH-���ʴ�Ϊ��2Cl-+2H2O
Cl2��+H2��+2OH-���ʴ�Ϊ��2Cl-+2H2O![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
��2��Br2��Na2CO3��Ӧ����NaBrO3��NaBr��CO2��BrԪ�ز�����0�����ߵ�+5������һ���ִ�0�۽��͵�-1���������ɵ�NaBrO3��NaBr�����ʵ���֮��Ϊ1��5��������ƽ����ʽΪ��3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2�����ʴ�Ϊ��3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2����
��3����±��ˮ�ܽ⣬��NaClO��Fe2+������Fe3+��Ȼ�����NaOH����pHΪ9.8��ʹFe2+��Fe3+��Mn2+ת��Ϊ����������������ˣ���Һ��������Ũ������ȴ�ᾧ�����˵õ����Ȼ�þ���壬��HCl�����м��ȵõ���ˮ�Ȼ�þ��������ڵ��Ȼ�þ�õ�Mg��
���������������pH=9.8����ʹ��Mg2+����ĸ������ʽ������Ӷ�������������������Ա�ͨ�����˶���ȥ��������pH=9.8��Ŀ�ģ���ȥ��Һ�к��е�Fe2+��Fe3+��Mn2+���ʣ�ʹ֮��ȫ���ɳ�������ȥ���ʴ�Ϊ����ȥ��Һ�к��е�Fe2+��Fe3+��Mn2+���ʣ�ʹ֮��ȫ���ɳ�������ȥ��
������������ƻ�������������Ϊ�������������������Fe2+��H2O��Ӧ����Fe(OH)3��Cl-��H+����Ӧ�����ӷ���ʽΪ��ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+���ʴ�Ϊ��ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+��
��NaClO���ܳ�ȥ��±�е�CO(NH2)2�������κ��ܲ������ѭ�������ʣ��䷴ӦΪ3NaClO+CO(NH2)2�T3NaCl+CO2��+N2��+2H2O���ɷ���ʽ������֮��Ĺ�ϵ��֪��0.1mol CO(NH2)2����NaClOΪ0.3mol����m(NaClO)=nM=0.3mol��74.5g/mol=22.35g���ʴ�Ϊ��22.35��

 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�����Ŀ������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�������֪���±�����(25 ��)��
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.4��10��7��K2��4.7��10��11 |
��1��25 ��ʱ����Ũ�ȵ�������Һ(A��NaCN��Һ��B��Na2CO3��Һ��C��CH3COONa��Һ)��pH�ɴ�С��˳��Ϊ________________________________��(��д���)
��2��25 ��ʱ����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ______ ___��
��3������Ũ��Ϊ0.02 mol/L��HCN��0.01mol/L NaOH�������Ϻ��c(Na+)��c(CN-)�����й�ϵ��ȷ���� ��
A��c(H+)��c(OH-)
B��c(H+)��c(OH-)
C��c(H+)+c(HCN) = c(OH-)
D��c(HCN)+ c(CN-)=0.01mol/L
��4��Ũ��Al2(SO4)3��Һ��Ũ��С�մ�(NaHCO3)��Һ��Ͽ�����������������ӷ�Ӧ����ʽ��ʾ����ԭ��_____________________��
��5����֪NaHC2O4ˮ��Һ�����ԣ���д������Һ�и�����Ũ�ȵĴ�С___________________������غ����ʽ ___________________ ��
��6��H2C2O4��Һ��KMnO4������Һ�ɷ�����Ӧ��H2C2O4��MnO4-��H����CO2��Mn2����H2O����Ӧ��ÿ���ɱ����4.48LCO2���壬ת�Ƶĵ��ӵ����ʵ���Ϊ__________mol��