题目内容
【题目】铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.根据所学知识回答下列问题:
(1)铁原子价电子轨道表示式为______,与铁同周期的元素的基态原子中,最外层电子数与铁相同的元素共有_____种(包含铁)。
(2)下列关于铁的说法,不正确的是_____(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2违反了泡利原理
B.铁属于黑色金属,在周期表中属于ds区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,配体CO中C是配原子
(3)某铁的化合物结构简式如图所示。
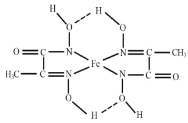
①组成上述化合物中5种元素原子电负性由小到大的顺序为_____。
②上述化合物中氮原子的杂化方式有_____。
③在图中用“→”标出亚铁离子的配位键_____。
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是后者,原因是_____。
【答案】3d642 9 BC O>N>C>H>Fe sp2、sp3  异硫氰酸中 H-N 键极性强,分子间存在氢键
异硫氰酸中 H-N 键极性强,分子间存在氢键
【解析】
(1)Fe为26号元素,所以其价电子排布式为3d642;其最外层电子排布为4s2;与铁同周期的副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数可以为1、2、3、5、7、8、10,共7种,主族元素还有Ca,包括Fe共9种;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.铁在元素周期表中属于d区,故B错误;
C.铁的焰色反应发出的光为无色不影响其它金属火焰颜色,所以铁丝可用于焰色反应实验,故C错误;
D.CO分子中碳氧之间有一个有氧原子问提供的配位键,使碳周围的电子云密度增加,容易给出电子,所以碳提供电子做配原子,故D正确;
综上所述答案为BC;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外的N原子带1个单位负电荷,与亚铁离子之间形成离子键,如图 ;
;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
编号 | ① | ② | ③ | ④ |
A中气体 | H2S | H2 | NH3 | NO |
B中气体 | SO2 | Cl2 | HCl | O2 |
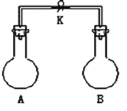
A.②③④①B.③①④②
C.③②①④D.④③②①