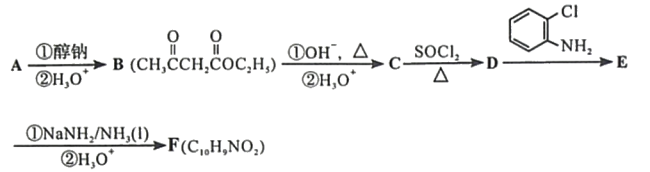
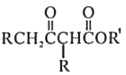
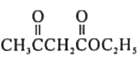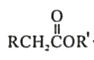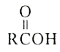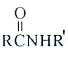题目内容
【题目】用惰性电极电解物质的量浓度相同、体积比为2∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③B.①②④C.②③④D.②④
【答案】B
【解析】
不妨设混合溶液的体积为1L,硫酸铜的浓度为2mol/L,则NaCl的浓度为3mol/L,n(CuSO4)=n(Cu2+)=2mol,n(NaCl)=n(Cl-)=3mol;
电解过程中阳极开始为Cl-放电生成Cl2,阴极Cu2+放电生成Cu,此时总反应为Cu2++2Cl-![]() Cu+Cl2↑;
Cu+Cl2↑;
n(Cl-)=3mol,所以当转移3mol电子时Cl-完全反应,阳极变为水电离出的氢氧根放电生成氧气,阴极Cu2+放电生成Cu,总反应为2Cu2++2H2O![]() 2Cu+4H++O2↑;
2Cu+4H++O2↑;
n(Cu2+)=2mol,所以当转移4mol电子时Cu2+也完全反应,阴极反应为水电离出的氢离子放电生成氢气,阳极水电离出的氢氧根放电生成氧气,总反应为2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
综上所述答案为B。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目