题目内容
【题目】下列有关热化学方程式的叙述正确的是( )
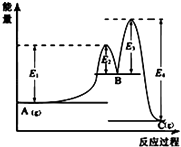
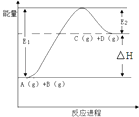
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
【答案】D
【解析】解:A、反应物的总能量高于生成物的总能量时,反应是放热反应,但有些反应需要一定条件下才能反应;故A错误; B、氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJmol﹣1 ;故B错误;
O2(g)=H2O(l)△H=﹣285.8kJmol﹣1 ;故B错误;
C、将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣57.3kJmol﹣1 ;故C错误;
D、2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,反应存在化学平衡,不能进行彻底,充分反应后放出的热量一定小于QkJ,故D正确;
故选D.

练习册系列答案
相关题目