题目内容
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余均为短周期主族元素;
②A的内层电子总数是最外层电子数的一半;
③C、E同主族且C原子最外层电子数是次外层电子数的3倍;
④D是金属性最强的短周期元素。完成下列问题
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半径由小到大顺序是_________ (用元素符号表示)。
(3)已知D在C的单质中燃烧生成淡黄色的固体化合物甲,甲的化学式为_______________,电子式为_______,甲中的化学键类型为____________________。
(4)A的单质与E的最高价含氧酸反应的化学方程式 。
【答案】(1)第四周期ⅠB族
(2)O<N<S<Na
(3)Na2O2![]() 共价键和离子键(或非极性共价键和离子键)
共价键和离子键(或非极性共价键和离子键)
(4)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】试题分析:F的原子序数为29,则F为Cu元素;A的内层电子总数是最外层电子数的一半,可知A为碳元素;C、E同主族且C原子最外层电子数是次外层电子数的3倍,则C为氧元素,E为硫元素,并可知B为氮元素;D是金属性最强的短周期元素,可知D为钠元素;
(1)铜元素在元素周期表的位置为第四周期ⅠB族。
(2)同周期主族元素核电荷数越大,原子半径越小,则N、O、Na、S的原子半径由小到大顺序是O<N<S<Na。
(3)Na在氧气中燃烧生成淡黄色的固体Na2O2,其电子式为![]() ,含有的化学键类型为共价键和离子键。
,含有的化学键类型为共价键和离子键。
(4)C与浓硫酸混合加热,发生反应的化学方程式为C+2H2SO4(浓)A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余均为短周期主族元素;
②A的内层电子总数是最外层电子数的一半;
③C、E同主族且C原子最外层电子数是次外层电子数的3倍;
④D是金属性最强的短周期元素。完成下列问题
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半径由小到大顺序是_________ (用元素符号表示)。
(3)已知D在C的单质中燃烧生成淡黄色的固体化合物甲,甲的化学式为_______________,电子式为_______,甲中的化学键类型为____________________。
(4)A的单质与E的最高价含氧酸反应的化学方程式 。
CO2↑+2SO2↑+2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
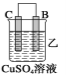
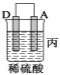
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。