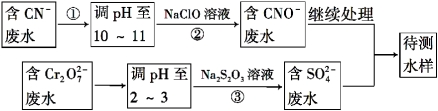
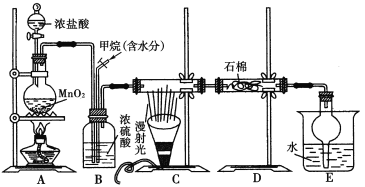
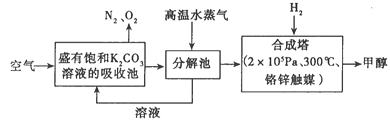
题目内容
【题目】中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,且相对分子质量X>Y,则该反应的化学方程式________,检验Y中阴离子的试剂是__________。
(2)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行。写出A与B反应的离子方程式: ; 。
(3)若A为常见的非金属单质,它是构成有机物的基本元素之一,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,则该反应化学方程式为 。
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出A与B反应生成Y的离子方程式 。
【答案】(1)Cl2+SO2+2H2O==2HCl+H2SO4,硝酸银和稀硝酸;(2)2Al+6H+===2Al3++3H2↑,2Al+2OH-+2H2O===2AlO2-+3H2↑;(3)C + 4HNO3 (浓) ![]() 2H2O +4NO2↑+CO2↑;(4) SiO32-+ CO2+ H2O=CO32-+ H2SiO3↓。
2H2O +4NO2↑+CO2↑;(4) SiO32-+ CO2+ H2O=CO32-+ H2SiO3↓。
【解析】
试题分析:(1)A为黄绿色气体,则A为Cl2,B为非金属氧化物,且B能使品红溶液褪色,则B为SO2,SO2具有还原性,Cl2具有强氧化性,两者发生反应的方程式为Cl2+SO2+2H2O=2HCl+H2SO4,因X的相对分子质量大于Y的相对分子质量,则X:H2SO4,Y:HCl,检验Cl-用硝酸酸化的AgNO3溶液,有白色沉淀产生,说明有Cl-;(2)B溶液呈强酸性或强碱性,A为金属单质,B无论显酸性还是碱性,都能和A反应,说明A为Al,则Y为氢气,离子反应方程式为:2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)A为常见的非金属单质,是构成有机物的基本元素之一,说明A为C,B为浓酸,根据C的性质,可以和浓硫酸反应:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,也可以和浓硝酸反应,反应方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,A、B的物质的量之比为1:4,则应是C和浓硝酸的反应;(4)B为引起温室效应的主要气体,则B为CO2,A、B均为化合物,Y为不含金属元素的白色沉淀,因此A为硅酸盐,Y为硅酸,其离子反应方程式为:SiO32-+ CO2+ H2O=CO32-+ H2SiO3↓。
CO2↑+2SO2↑+2H2O,也可以和浓硝酸反应,反应方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,A、B的物质的量之比为1:4,则应是C和浓硝酸的反应;(4)B为引起温室效应的主要气体,则B为CO2,A、B均为化合物,Y为不含金属元素的白色沉淀,因此A为硅酸盐,Y为硅酸,其离子反应方程式为:SiO32-+ CO2+ H2O=CO32-+ H2SiO3↓。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案