题目内容
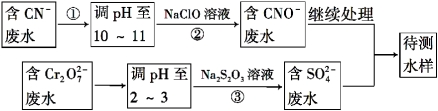
【题目】下列实验步骤是兴趣小组对某混合样品含量的测定,样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定。(步骤中所加试剂均为足量)
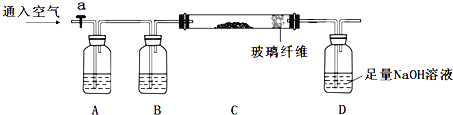
①称量mg样品灼烧。装置如下:
②D瓶溶液![]()
![]()
![]() 固体(ag)
固体(ag)
③![]()
请回答下列问题:
(1)连接好仪器后,如何检查整套装置的气密性_______________。
(2)A瓶内所盛试剂是__________溶液。灼烧完成后熄灭酒精灯,若立即停止通空气,可能对实验的影响是(写两点) _________________________。
(3)步骤②中加入双氧水的离子方程式为____________________。若此步骤不加入双氧水对测定硫元素含量的影响是_____________(填“偏高”、“偏低”或“无影响”)。
(4)连续操作1为_________、洗涤、_________、称量;连续操作2为洗涤、_________、称量。
(5)从步骤③的bg滤渣入手,可测定SiO2的含量,下面各组试剂中不适合测定的是___________。
A.NaOH溶液 、稀硫酸 B.Ba(OH)2溶液、盐酸 C.氨水、稀硫酸 D.NaOH溶液、盐酸
(6)求样品中FeO的质量分数(列出算式即可)____________________。
【答案】(1)向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;
(2)氢氧化钠(氢氧化钾、或其他合理答案);D中溶液倒吸、SO2不能全部排出(或测得硫元素的含量偏低);
(3)SO32-+H2O2=SO42-+H2O;偏高;
(4)过滤、干燥(烘干);灼烧(填“干燥(烘干)”不给分)
(5)BC;
(6) 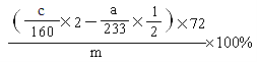 ;
;
【解析】
试题分析:样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定,mg样品灼烧FeS2燃烧生成Fe2O3和SO2。
①A瓶是氢氧化钠溶液吸收空气中的二氧化碳等酸性气体,B装置是浓硫酸干燥气体,C装置是样品灼烧得到氧化铁固体和二氧化硅,装置D是吸收生成的二氧化硫气体生成亚硫酸钠;
②D瓶中加入过氧化氢氧化亚硫酸钠为硫酸钠,加入氯化钡溶液形成硫酸钡沉淀,过滤、洗涤、干燥得到固体为BaSO4ag;
③C中固体为FeO、Fe2O3和SiO2和其他杂质,加入稀硫酸溶解生成硫酸亚铁、硫酸铁溶液,过滤得到滤渣为SiO2和其他杂质bg,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入氢氧化钾溶液沉淀铁离子为Fe(OH)3,过滤得到滤渣洗涤干燥后灼烧得到红褐色固体Fe2O3质量为cg;
(1)检查整套装置的气密性,先连接好仪器后,关闭紧止水夹a,微热C,依据导气管气泡冒出,停止加热导气管中有水柱上升证明气密性完好,具体步骤为:向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;故答案为:向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后,若D导管中形成一段稳定的水柱,则气密性良好;
(2)上述分析可知A中是氢氧化钠溶液,用来吸收通入空气中二氧化碳,避免影响后续实验测定,灼烧完成后熄灭酒精灯,若立即停止通空气,可能会引起倒吸,生成的二氧化硫不能全部进入装置D中吸收等;故答案为:氢氧化钠,D中溶液倒吸、SO2不能全部排出或测得硫元素的含量偏低;
(3)过氧化氢是氧化亚硫酸根离子为硫酸根离子全部沉淀,步骤②中加入双氧水的离子方程式为:SO32-+H2O2=SO42-+H2O,如不加入过氧化氢氧化,生成的沉淀含有BaSO3,称量过程中易被空气中氧气氧化,计算得到硫元素质量偏高;故答案为:SO32-+H2O2=SO42-+H2O,偏高;
(4)依据上述分析可知,实验过程中连续操作1是过滤、洗涤、干燥、称量;连续操作2是洗涤、干燥、灼烧、称量;故答案为:过滤,干燥,灼烧;
(5)③C中固体为FeO、Fe2O3和SiO2和其他杂质,加入稀硫酸溶解生成硫酸亚铁、硫酸铁溶液,过滤得到滤渣为SiO2和其他杂质bg,杂质不与酸碱反应,受热稳定,从步骤③的bg滤渣入手,可测定SiO2的含量是利用加入的试剂溶解二氧化硅后过滤得到不溶性杂质,滤液中加入酸沉淀硅酸根离子形成硅酸沉淀,洗涤干燥称量,元素守恒计算得到二氧化硅质量,得到二氧化硅的含量;A.NaOH溶液、以溶解二氧化硅,稀硫酸和硅酸钠反应生成硅酸沉淀,可以测定二氧化硅含量,故A符合;B.Ba(OH)2溶液和二氧化硅反应生成硅酸钡是沉淀,不能和杂质分离、不能用来测定含量,故B不符合;C.氨水不能溶解二氧化硅,不能分离不溶性杂质,故C不符合;D.NaOH溶液、以溶解二氧化硅,稀盐酸和硅酸钠反应生成硅酸沉淀,可以测定二氧化硅含量,故D符合;故答案为:BC;
(6)依据铁元素守恒分析计算,实验③中得到的固体是氧化铁质量为cg,实验②是FeS2中硫元素最后生成硫酸钡沉淀为ag,据此可以依据硫元素守恒计算原样品中FeS2的物质的量,原样品中FeO物质的量应是铁元素总物质的量减去FeS2中铁元素物质的量,氧化铁物质的量=![]() =
=![]() mol,含有铁元素物质的量=
mol,含有铁元素物质的量=![]() mol×2,依据硫元素守恒,Fe~FeS2~2H2SO4~2BaSO4,则FeS2中铁元素物质的量=
mol×2,依据硫元素守恒,Fe~FeS2~2H2SO4~2BaSO4,则FeS2中铁元素物质的量=![]() ×
×![]() mol,氧化亚铁FeO中铁元素物质的量=
mol,氧化亚铁FeO中铁元素物质的量=![]() mol×2-
mol×2-![]() ×
×![]() mol,得到氧化亚铁的质量分数为:
mol,得到氧化亚铁的质量分数为: ×100%;故答案为:
×100%;故答案为: ×100%。
×100%。