题目内容
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、C12反应合成氯化亚砜。发生如下反应:
①C12(g)+SO2(g)![]() SO2C12(g) △H=-471.7kJ·mol-1
SO2C12(g) △H=-471.7kJ·mol-1
②SO2C12(g)+SCl2(g)![]() 2SOC12(g)△H=-5.6kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1
567K时,在10L密闭容器中,充入一定量的C12、SO2和SCl2,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化(反应达到平衡时的温度与初始温度相同)如下图所示,起始各组分及达平衡时SO2C12(g)的物质的量如下表。
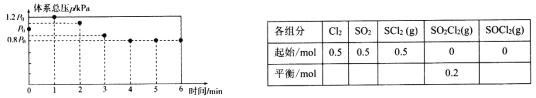
(1)0~1min,图中数据显示体系压强增大的原因是________________。
(2)0~4min内,v(C12)=_____mol·L-1·min-1,5min时SCl2的转化率为________。
(3)567K时,上述反应②的KP______。
(4)567K下,若扩大容器体积为20L,则平衡时c(SO2)_____(填“大于”“小于”或“等于”)上述反应平衡时的c(SO2)。
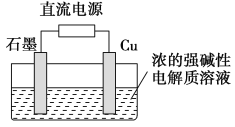
II.Li/SOCl2电池是一种高比能量电池,电解液为非水的LiAlC14的SOCl2溶液。正极为金属酞菁配合物(M-Pe,电池正极催化剂)附着的碳棒。正极催化过程为:SOCl2先与酞菁形成加合物,接着发生加合物的两步快速的电子转移,过程如图所示。
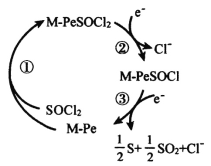
(5)上述正极催化过程M-PeSOCl2为_______(填“催化剂”或“中间产物”),放电过程中每转移1mol电子生成_____g硫单质。电池总反应的化学方程式为_______________________________________。
【答案】反应为放热反应,温度升高使体系压强增大 7.5×10-3 20% 0.5 小于 中间产物 8 4Li+2SOCl2==4LiCl+SO2↑+S
【解析】
I.利用三段式求解;
II.根据图像直接判断。
I.(1)0~1min,在10L密闭容器中,发生反应①、②,且反应均为放热反应,气体受热膨胀,导致压强增大;
(2)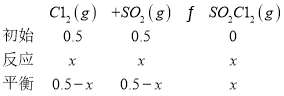

在恒温恒容的密闭容器中,压强之比等于物质的量之比,则1.5:(1.7-2x+y)=1:0.8,化简2x-y=0.5,结合x-y=0.2,求解x=0.3,y=0.1;根据图像,反应4min时达到平衡状态,0~4min内,消耗氯气0.3mol,则v(C12)=![]() =7.5×10-3mol·L-1·min-1;5min时,参加反应的SCl2的物质的量为0.1mol,转化率=
=7.5×10-3mol·L-1·min-1;5min时,参加反应的SCl2的物质的量为0.1mol,转化率=![]() ×100%=20%;
×100%=20%;
(3)567K时,SO2C12的分压为![]() ×0.8P0=
×0.8P0=![]() P0,SCl2的分压为
P0,SCl2的分压为![]() ×0.8P0=
×0.8P0=![]() P0,SOC12的分压为
P0,SOC12的分压为![]() ×0.8P0=
×0.8P0=![]() P0,KP=(
P0,KP=(![]() P0)2÷(
P0)2÷(![]() P0×
P0×![]() P0)=0.5;
P0)=0.5;
(4)567K下,若扩大容器体积为20L,反应①平衡逆向移动,但体积增大一倍,导致c(SO2)小于上述反应平衡时的c(SO2)。
II.(5)根据过程图可知,M-PeSOCl2为中间产物;②得1mol电子,③得1mol电子,生成0.5mol的S,故放电过程中每转移1mol电子生成0.25molS,即8g;放电时,Li失电子,生成锂离子,SOCl2得电子生成S、SO2、Cl-,总反应式为4Li+2SOCl2==4LiCl+SO2↑+S。

【题目】—定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如图所示。
容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | ||||
NO(g) | CO(g) | N2 | CO2 | |||
甲 | T1 | 0.10 | 0.10 | 0 | 0 | |
乙 | T2 | 0 | 0 | 0.10 | 0.20 | |
丙 | T2 | 0.10 | 0.10 | 0 | 0 | |

下列说法正确的是( )
A.该反应的正反应为吸热反应
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10molNO和0.10molCO2,此时v(正)<v(逆)