题目内容
【题目】氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1)已知断裂下列化学键需要吸收的能量分别为:![]() ,
,![]() ,
,![]() ,写出以N2和H2为原料合成NH3的热化学方程式______。
,写出以N2和H2为原料合成NH3的热化学方程式______。
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图 所示:
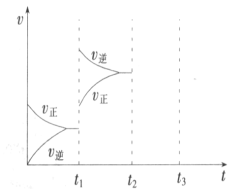
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像_____________。
【答案】N2(g)+3H2(g)![]() 2NH3(g) △H= -90.8 kJ·mol-1 升高温度
2NH3(g) △H= -90.8 kJ·mol-1 升高温度 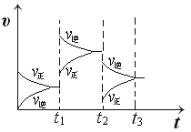
【解析】
(1)根据反应热△H=反应物总键能-生成物总键能计算;
(2)①t1时刻改变的条件后正逆反应速率都增大,平衡逆移;②t2恒压充入氦气,体积膨胀,参加反应的气体所占分压减小,平衡向体积增大方向移动,据此画出图象。
(1)N2和H2为原料合成NH3的反应为N2(g)+3H2(g)2NH3(g)△H=反应物总键能-生成物总键能=946.0kJmol-1+3×436.0kJmol-1-6×390.8kJmol-1=-90.8 kJmol-1;故答案为:N2(g)+3H2(g)2NH3(g)△H=-90.8 kJmol-1;
(2)①t1时刻改变的条件后正逆反应速率都增大,逆反应速率大于正反应速率,平衡逆移,所以改变条件为升高温度,故答案为:升高温度;
②t2恒压充入氦气,体积膨胀,各反应物质浓度减小,参加反应的气体所占分压减小,平衡向体积增大方向移动,正逆反应速率都减小,画出图象为: ,故答案为:
,故答案为: 。
。

练习册系列答案
相关题目