题目内容
5.已知: ,如果要合成
,如果要合成 ,所用的起始原料可以是( )
,所用的起始原料可以是( )| A. | 2-甲基-1,3-丁二烯和1-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3戊二烯和乙炔 | D. | 2,3-二甲基-1,3-丁二烯和丙炔 |
分析 由 可知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,乙炔中有一个键断裂,且形成环状结构,采用逆合成分析法可知,要合成
可知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,乙炔中有一个键断裂,且形成环状结构,采用逆合成分析法可知,要合成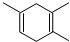 ,逆向推断
,逆向推断 或者是
或者是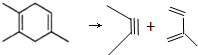 ,以此解答该题.
,以此解答该题.
解答 解:合成 ,逆向推断
,逆向推断 或者是
或者是 ,
,
若为 ,则结合有机物的命名原则可知两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
,则结合有机物的命名原则可知两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
若为 ,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
故选D.
点评 本题考查有机物合成及结构与性质,为高频考点,把握常见有机物官能团与性质、反应类型为解答的关键,注重知识迁移应用的考查,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
15.加成反应也是有机化学中的一类重要的反应类型,下列各组物质中不能发生加成反应的是( )
| A. | 聚乙烯 | B. | 聚乙炔 | C. | 氯乙烯 | D. | 苯 |
16.有关蛋白质的叙述正确的是( )
| A. | 鸡蛋白溶液中,加入浓的硫酸铵溶液有沉淀析出,加入水后沉淀不溶解 | |
| B. | 蛋白质水解的最后产物是氨基酸 | |
| C. | 蛋白质和浓硝酸作用时呈白色 | |
| D. | 重金属盐使蛋白质变性,所以吞食“钡餐”(含BaSO4)会引起中毒 |
20.在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为( )
| A. | n/8mol-1 | B. | n/16 mol-1 | C. | 8n mol-1 | D. | 4n mol-1 |
10.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
17.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| D. | 58.5 g的NaCl固体中含有NA个氯化钠分子 |
14.如表对于官能团的表示正确的是( )
| 羟基的电子式 | 酯基结构简式 | 碳碳双键结构简式 | 醛基电子式 |
| ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H | -COOC- | C=C | 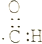 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
15.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |

 请回答下面问题:
请回答下面问题: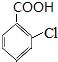 +3NaOH$\stackrel{水}{→}$
+3NaOH$\stackrel{水}{→}$ +NaCl+2H2O
+NaCl+2H2O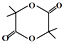
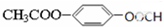 、
、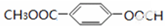 .
.