题目内容
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
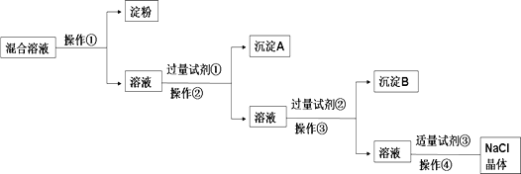
(1)写出上述实验过程中所用试剂:试剂①____;试剂③____。
(2)判断试剂①已过量的方法是:_____。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉___(填“能”或“不能”)透过半透膜。
(4)操作④的名称是____,其中玻璃棒的作用是____。
【答案】BaCl2 稀盐酸 取少量上层清液于试管中,再滴加少量BaCl2溶液,若无白色沉淀生成,则已经过量 不能 蒸发结晶 搅拌
【解析】
胶体不能透过半透膜,操作①为渗析,将淀粉与溶液分离,除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,
(1)由以上分析可知试剂①为BaCl2,试剂③为盐酸;
故答案为:BaCl2;盐酸;
(2)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量;
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;
(3)胶体粒子和浊液粒子半径比较大,不能透过半透膜,而溶液中溶质粒子可通过半透膜;
故答案为:不能;
(4)操作④由溶液得到晶体,为蒸发结晶操作,其中会使用玻璃棒搅拌来加速蒸发;
故答案为:蒸发结晶;搅拌。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取相同物质的量的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
请回答下列问题:
(1)要算出盐酸的物质的量,题中作为计算依据的数据是___,求得的盐酸的溶质物质的量为___;
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是___,求得请务必写出计算过 程:___。