题目内容
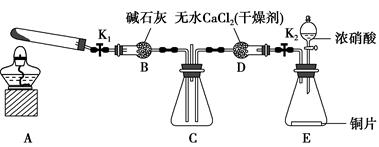
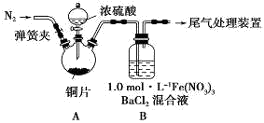
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。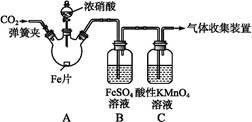
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 。
(3)甲取少量B中溶液,加热,实验现象是 。请用化学平衡原理解释原因: 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 ,证明有NO生成的实验现象是 。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号) 。
A.铁粉 B.溴水 C.铁氰化钾溶液 D.硫氰化钾溶液
(1)常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生(答“钝化”也可)
(2)取少量反应后A中溶液放入试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成N
(3)棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色
FeSO4+NO Fe(NO)SO4(棕色) ΔH<0,正反应放热,加热后,平衡向逆反应方向移动
Fe(NO)SO4(棕色) ΔH<0,正反应放热,加热后,平衡向逆反应方向移动
(4)浓硝酸换成稀硝酸 A中没有红棕色气体生成,B中溶液变为棕色
(5)D
解析

练习册系列答案
相关题目

 2KNO2↑+O2↑
2KNO2↑+O2↑
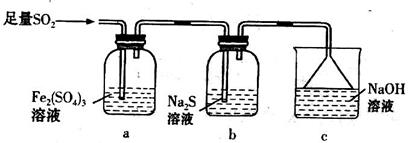
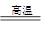 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
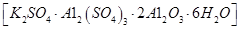 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: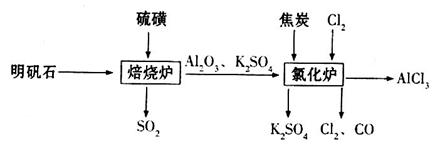
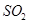 的方法是________________________________。
的方法是________________________________。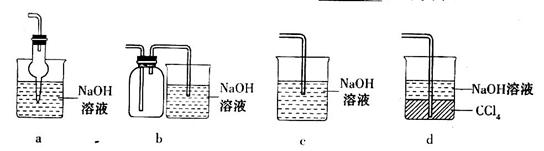
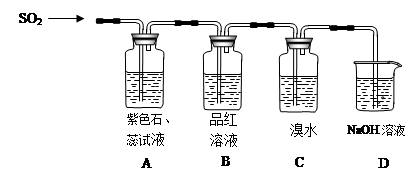
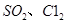 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)