题目内容
【题目】某同学在实验室以铜屑(含有少量CuO)为原料制备适量无水Cu(NO3)2工艺流程如图:
![]()
已知:①SOCl2熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体;
②4NH3·H2O+Cu2+=[Cu(NH3)4]2++4H2O;
[Cu(NH3)4]2+对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比。回答下列问题:
(1)从绿色化学、原子经济性角度考虑,试剂X为__。
(2)步骤II包括蒸发浓缩、冷却结晶等步骤,蒸发时所用容器名称是__,停止加热的时机是__。
(3)步骤III在如图1所示装置(夹持及控温装置省略)中进行。
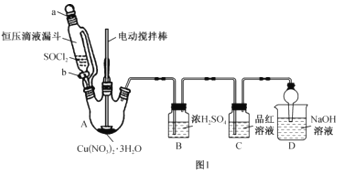
①实验中,若仅打开装置活塞b的情况下,恒压滴液漏斗中液体__(填“能”或“不能”)全部流下。
②C中产生的现象是__。
③D的作用是__。
④写出A中三颈烧瓶内Cu(NO3)2·3H2O与SOCl2恰好反应生成Cu(NO3)2的化学方程式:__。
(4)用分光光度法可测定产品的纯度。现准确称取0.50g无水Cu(NO3)2产品,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.600。已知[Cu(NH3)4]2+的吸光度A与Cu2+标准溶液浓度关系如图2所示。
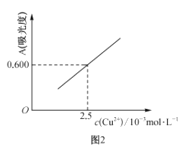
①量取10.00mLCu(NO3)2溶液所用量器名称是__。
②无水Cu(NO3)2的纯度是__(以质量分数表示)。
【答案】O2(或H2O2)与稀硝酸 蒸发皿 当蒸发皿中液体出现结晶膜或有一定量的晶体析出时 能 品红溶液褪色 吸收尾气SO2和HCl,防止其污染空气 ![]() 1 酸式滴定管 94.0%
1 酸式滴定管 94.0%
【解析】
(1)从绿色化学、原子经济性角度考虑,由铜屑制取硝酸铜溶液时,若只有铜与硝酸反应,则会生成氮氧化物,既污染环境,硝酸的利用率也低,因此应从提高硝酸的利用率,并减少氮氧化物的生成角度考虑;
(2)根据蒸发浓缩、冷却结晶的操作分析;
(3)步骤III![]() 与
与![]() 反应生成无水硝酸铜,已知SOCl2遇水剧烈水解生成两种酸性气体,应为二氧化硫和氯化氢,则装置A中发生的反应为
反应生成无水硝酸铜,已知SOCl2遇水剧烈水解生成两种酸性气体,应为二氧化硫和氯化氢,则装置A中发生的反应为
![]() ,据此解答;
,据此解答;
(4)②由图像可知,当溶液吸光度A=0.600时,Cu2+标准溶液的浓度为2.5×10-3mol/L,再计算0.50g无水Cu(NO3)2产品中Cu(NO3)2的物质的量,进而无水Cu(NO3)2的纯度。
(1)从绿色化学、原子经济性角度考虑,由铜屑制取硝酸铜溶液时,为提高硝酸的利用率,并减少氮氧化物的生成,可通入氧气或者加入过氧化氢溶液作氧化剂,硝酸只表现酸性,则试剂X为O2(或H2O2)与稀硝酸,故答案为:O2(或H2O2)与稀硝酸;
(2)步骤II包括蒸发浓缩、冷却结晶等步骤,蒸发时所用容器为蒸发皿,当蒸发皿中液体出现结晶膜或有一定量的晶体析出时,停止加热,再进行冷却结晶,故答案为:蒸发皿;当蒸发皿中液体出现结晶膜或有一定量的晶体析出时;
(3)步骤III![]() 与
与![]() 反应生成无水硝酸铜,已知SOCl2遇水剧烈水解生成两种酸性气体,应为二氧化硫和氯化氢,则装置A中发生的反应为
反应生成无水硝酸铜,已知SOCl2遇水剧烈水解生成两种酸性气体,应为二氧化硫和氯化氢,则装置A中发生的反应为
![]()
①恒压滴液漏斗内和三颈烧瓶内压强一致,则液体能全部流下,故答案为:能;
②A装置中,![]() 与
与![]() 反应生成二氧化硫,则C中品红溶液褪色,故答案为:品红溶液褪色;
反应生成二氧化硫,则C中品红溶液褪色,故答案为:品红溶液褪色;
③D装置用来吸收尾气SO2和HCl,防止其污染空气,故答案为:吸收尾气SO2和HCl,防止其污染空气;
④由以上分析知,A中化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)①Cu(NO3)2溶液,由于水解显弱酸性,则量取10.00mLCu(NO3)2溶液所用量器为酸式滴定管,故答案为:酸式滴定管;
②由图像可知,当溶液吸光度A=0.600时,Cu2+标准溶液的浓度为2.5×10-3mol/L,则所移取的10.00mL原Cu(NO3)2溶液中溶质物质的量为2.5×10-3mol/L×0.1L=2.5×10-4mol,则0.50g无水Cu(NO3)2产品中Cu(NO3)2的物质的量为2.5×10-4mol×10=2.5×10-3mol,则无水Cu(NO3)2的纯度是![]() ,故答案为:94.0%。
,故答案为:94.0%。

 名校课堂系列答案
名校课堂系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c