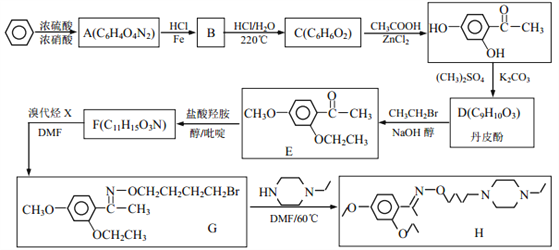
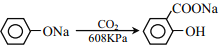
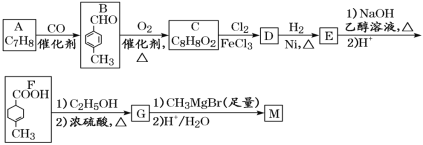
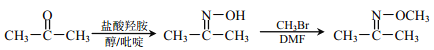题目内容
【题目】(1)H、D、T三种原子,在标准状况下,它们的单质的密度之比是_______,它们与氧的同位素16O、18O相互结合为水,可得水分子的种数为_______;[14NH3T]+ 中,电子数、质子数、中子数之比为_____
(2)核内中子数为N的R2+,质量数为A,则n g它的同价态氧化物中所含电子的物质的量为____________。
(3)含6.02×1023个中子的![]() 的质量是______g
的质量是______g
(4)①Ne ②HCl ③P4 ④N2H4 ⑤Mg3N2 ⑥Ca(OH)2 ⑦CaC2 ⑧NH4I ⑨AlCl3,请用上述物质的序号填空,只存在极性共价键的是____________,只存在非极性共价键的是_______________。既存在离子键又存在非极性共价键的是_____________。
(5)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水 ⑤Na2O2溶于水,未发生化学键破坏的是_____________,仅发生离子键破坏的是_____________仅发生共价键破坏的是_________,既发生离子键破坏又发生化学键破坏的是_______。(填写序号)
【答案】1∶2∶3 12 10∶11∶9 ![]() ×(A-N+8) 1.75或7/4 ②⑨ ③ ⑦ ① ②③ ④ ⑤
×(A-N+8) 1.75或7/4 ②⑨ ③ ⑦ ① ②③ ④ ⑤
【解析】
(1)同温同压下,气体摩尔体积相等,根据ρ=![]() 计算其单质的密度之比;根据1个水分子是由两个氢原子和1个氧原子构成来分析;结合离子符号,计算含有电子数、质子数、中子数进行判计算;
计算其单质的密度之比;根据1个水分子是由两个氢原子和1个氧原子构成来分析;结合离子符号,计算含有电子数、质子数、中子数进行判计算;
(2)核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,电子数为A-N;该离子带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16)g/mol,据此分析计算;
(3)根据n=![]() 计算中子物质的量,Li的中子数为7-3=4,进而计算Li的物质的量,再根据m=nM计算;
计算中子物质的量,Li的中子数为7-3=4,进而计算Li的物质的量,再根据m=nM计算;
(4)根据共价键和和离子键的定义判断。共价键:相邻原子间通过共用电子对形成的化学键;离子键:阴阳离子通过静电作用形成的化学键;共价键的极性根据成键元素判断;
(5)根据物质含有的化学键类型以及变化类型进行判断。
(1)质量数=质子数+中子数,三种原子的质量数分别为1、2、3,故在同温同压下,体积相等,故根据ρ=![]() =
=![]() 知,其密度之比等于其摩尔质量之比,故密度之比为1∶2∶3;由氧的同位素有16O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,若水分子中的氢原子相同,则16O可分别与11H、12H、13H构成水,即存在三种水;18O可分别与11H、12H、13H构成水,即存在三种水;若水分子中的氢原子不同,则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;所以共形成3×4=12种水;[14NH3T]+中电子数、质子数、中子数分别为10、11、(14-7+2)=9,故电子数∶质子数∶中子数=10∶11∶9,故答案为:1∶2∶3;12;10∶11∶9;
知,其密度之比等于其摩尔质量之比,故密度之比为1∶2∶3;由氧的同位素有16O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,若水分子中的氢原子相同,则16O可分别与11H、12H、13H构成水,即存在三种水;18O可分别与11H、12H、13H构成水,即存在三种水;若水分子中的氢原子不同,则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;所以共形成3×4=12种水;[14NH3T]+中电子数、质子数、中子数分别为10、11、(14-7+2)=9,故电子数∶质子数∶中子数=10∶11∶9,故答案为:1∶2∶3;12;10∶11∶9;
(2)该离子带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为![]() mol;1molRO中含有(A-N+8)mol质子,所以ng它的氧化物中所含质子的物质的量为
mol;1molRO中含有(A-N+8)mol质子,所以ng它的氧化物中所含质子的物质的量为![]() ×(A-N+8),质子数与电子数相同,所以电子的物质的量为:
×(A-N+8),质子数与电子数相同,所以电子的物质的量为:![]() ×(A-N+8)mol,故答案为:
×(A-N+8)mol,故答案为:![]() ×(A-N+8);
×(A-N+8);
(3)6.02×1023个中子物质的量为1mol,Li的中子数为7-3=4,故Li的物质的量为![]() mol=0.25mol,Li的质量=0.25mol×7g/mol=
mol=0.25mol,Li的质量=0.25mol×7g/mol=![]() g=1.75g,故答案为:1.75;
g=1.75g,故答案为:1.75;
(4)①Ne为单原子分子,不存在化学键;
②HCl中H原子和
③P4中存在P-P非极性共价键;
④N2H4中存在N-H极性共价键和N-N非极性共价键;
⑤Mg3N2中镁离子与氮离子间形成离子键;
⑥Ca(OH)2中钙离子和氢氧根离子间形成离子键;氢氧根离子内部氧原子、氢原子间形成极性共价键;
⑦CaC2 中钙离子和C22-间形成离子键;C22-内部碳原子之间形成非极性共价键;
⑧NH4I铵根离子与碘离子间形成离子键;铵根离子内部氮原子、氢原子间形成极性共价键;
⑨AlCl3是共价化合物,氯原子与铝原子形成极性共价键;
因此只存在极性共价键的是②⑨;只存在非极性共价键的是 ③;既存在离子键又存在非极性共价键的是⑦,故答案为:②⑨;③;⑦;
(5)①碘为分子晶体,升华时克服分子间作用力,没有化学键发生变化;
②烧碱为离子晶体,含有离子键和共价键,融化时离子键断裂,而共价键没有变化;
③MgCl2为离子化合物,溶于水没有发生化学变化,只发生离子键断裂;
④氯化氢为共价化合物,只含有共价键,溶于水没有发生化学变化,只发生共价键断裂;
⑤Na2O2含有离子键和共价键,溶于水发生化学反应,得到氢氧化钠和氧气,破坏离子键和共价键;
因此未发生化学键破坏的是 ①;仅发生离子键破坏的是 ②③;仅发生共价键破坏的是④,既发生离子键破坏又发生共价键破坏的是⑤,故答案为:①;②③;④;⑤。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c