题目内容
9.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如图: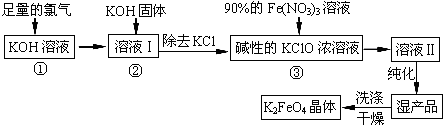
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.那么在温度较高时KOH 与Cl2反应转移5mol电子时,消耗的氯气是3mol.
(2)在反应液I中加入KOH固体的目的是A、C(填编号).
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH去体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)如何判断K2FeO4晶体已经洗涤干净用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净.
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42?+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
完成并配平上述反应的离子方程式.
分析 (1)根据题目信息,在温度较高时KOH 与Cl2反应方程式为6KOH+3Cl2$\frac{\underline{\;加热\;}}{\;}$KClO3+5KCl+3H2O,根据反应中电子转移数目计算氯气的物质的量;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)检验最后一次的洗涤中无Cl-即可
(5)根据氧化还原反应电子得失守恒配平;
解答 解:(1)在温度较高时KOH 与Cl2反应方程式为6KOH+3Cl2$\frac{\underline{\;加热\;}}{\;}$KClO3+5KCl+3H2O,在该反应中Cl2既是氧化剂又是还原剂,每3摩尔氯气反应可以转移5mol电子,所以反应转移5mol电子时,消耗的氯气是3mol,
故答案为:3;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;
(5)根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4;10;4;3;8OH-.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 向沸水中滴加饱和FeCl3溶液,持续加热最终能得到Fe(OH)3胶体 | |
| C. | “忽闻海上有仙山,山在虚无缥缈间”描述了一种与胶体有关的自然现象 | |
| D. | 水泥厂、冶金厂常用静电除尘法除去烟尘,利用了胶体带电的性质 |
| A. | 苯和己烷(溴水) | B. | 乙醛和丙烯酸(KMnO4溶液) | ||
| C. | 矿物油和植物油(NaOH溶液) | D. | 硝基苯和CCl4(水) |
| A. | 碱--①④ | B. | 电解质--③④⑤ | C. | 混合物--②③ | D. | 盐--②⑥ |
| A. | 使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水中:K+、Na+、Cl-、HSO3- | |
| C. | 室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
| A. | 22.4LCO质量为28g | |
| B. | 1mol/L的氯化钠溶液中含有1molNa+ | |
| C. | O2的摩尔质量是32 | |
| D. | 14g N2的物质的量是0.5mol |
| A. | 将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| B. |  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备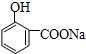 | |
| C. | 用分液法分离苯和液溴的混合物 | |
| D. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |