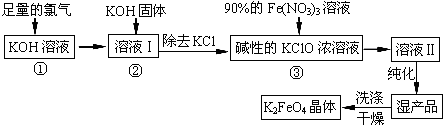
题目内容
14.在指定条件下,下列粒子一定能大量共存的是( )| A. | 使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水中:K+、Na+、Cl-、HSO3- | |
| C. | 室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
分析 A.使酚酞变红色的溶液呈碱性,铁离子与碱性溶液中的氢氧根离子反应;
B.亚硫酸氢根离子能够被氯水氧化;
C.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.硝酸根离子在酸性条件下能够氧化亚铁离子、亚硫酸根离子.
解答 解:A.使酚酞变红色的溶液中存在大量氢氧根离子,Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.氯水具有强氧化性,能够氧化HSO3-,在溶液中不能大量共存,故B错误;
C.pH=13的溶液中存在大量氢氧根离子,Na+、K+、SiO32-、Cl-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.NO3-、H+具有强氧化性,能够氧化Fe2+、SO32-,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,注意熟练掌握离子反应发生条件,明确常见的离子不能共存的情况,如:发生复分解反应、发生氧化还原反应等,试题培养了学生的灵活运用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在离子方程式中,反应前后可以不相等的是( )
| A. | 原子总数 | B. | 离子总数 | C. | 电荷总数 | D. | 元素种类 |
19.将质量分数为2w,物质的量浓度为c1的乙醇溶液加水稀释,使质量分数变为w,物质的量浓度变为c2,则c1和c2之间关系正确的是( )
| A. | c1>2c2 | B. | c2=2c1 | C. | c2<c1<2c2 | D. | c1=2c2 |
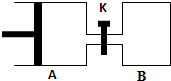
3.LiOH是制备锂离子电池的材料,可由电解法制备.工业上利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )

| A. | B极区电解液为LiCl溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2LiCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2LiOH |
4.下列各对物质,互为同分异构体的是( )
| A. | 丁烷与丁烯 | B. | 戊烷与2-甲基丁烷 | ||
| C. | 丁烯与丁炔 | D. | 氧与臭氧 |
 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答: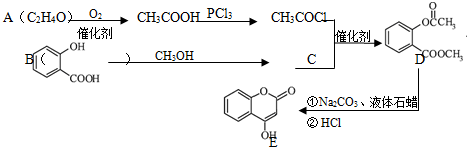
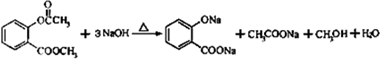 .
.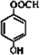 .
.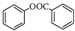 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: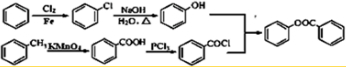 .
.