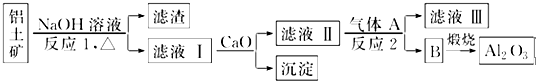
题目内容
18.硫及其化合物有广泛应用.(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大 d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.
(4)废气中的 SO2可用 NaOH 溶液吸收,吸收 SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
分析 (1)S的原子结构为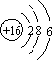 ,电子层数等于周期数,最外层电子数等于族序数;
,电子层数等于周期数,最外层电子数等于族序数;
(2)硒(34Se)与硫在元素周期表中位于同一主族,性质相似,非金属性S>Se;
(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),以此计算△H;
(4)氯气具有强氧化性,SO32-中+4价的硫具有还原性,氯气与SO32-会发生氧化还原反应;溶液显碱性时能与溴水反应,不能确定溴水与SO32-会发生氧化还原反应.
解答 解:(1)S的原子结构为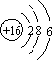 ,则S位于第三周期ⅥA族,
,则S位于第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)a.水中含氢键,沸点最高,则沸点:H2O>H2Se>H2S,故a错误;
b.非金属性S>Se,则H2Se比H2S稳定性弱,故b错误;
c.同主族,原子序数大的原子半径大,则Se的原子半径比S原子大,故c正确;
d.SeO2和SO2含有共价键,化学键类型相同,故d正确;
故答案为:c d;
(3)(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),则△H=(-545kJ/mol)-(-44kJ/mol)×2-(-130kJ/mol)×2=-197kJ/mol,
故答案为:-197;
(4)①吸收SO2后的碱性溶液还可用于Cl2的尾气处理,亚硫酸钠与氯气发生氧化还原反应生成硫酸钠和盐酸,则吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-,故答案为:SO42-、Cl-;
②滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色,
故答案为:NaOH溶液能跟溴单质反应,使溶液呈无色.
点评 本题考查较综合,涉及元素在周期表中的位置、盖斯定律计算、化学键及同族元素的性质等,综合性较强,侧重分析与应用能力及化学反应原理的考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | KAl (SO4)2=K++Al3++2 SO42- | B. | H2CO3=H++HCO3- | ||
| C. | Ca(HCO3)2=Ca2++2H++2CO32- | D. | Ba(OH)2=Ba2++OH2- |
| A. | NaOH(Na2CO3):适量Ba(OH)2溶液 | |
| B. | NaCl(Na2CO3):适量CaCl2溶液 | |
| C. | KCl(FeCl3):适量Ba(OH)2溶液 | |
| D. | KNO3(Ba(NO3)2):先加适量K2CO3溶液,再加适量HN03 |

| A. | B极区电解液为LiCl溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2LiCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2LiOH |
| A. | 硫酸的摩尔质量是98g | B. | 1mol N2的质量为28g/mol | ||
| C. | 阿伏伽德罗常数用符号为NA表示 | D. | 1mol氧的质量等于16g |
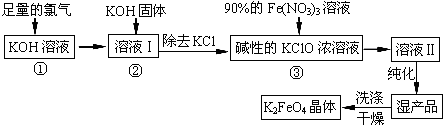
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).