题目内容
20.取少量Fe2O3粉末(红棕色)加入适量的盐酸,所发生反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,反应后得到的FeCl3溶液呈棕黄色.用此溶液进行以下反应.(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,此反应类型为复分解反应.
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴加几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,制得的分散系为Fe(OH)3胶体.
(3)怎样检验制得的物质是胶体?用激光笔照射,观察,有一条光亮的“通路”.
(4)将制得的Fe(OH)3胶体装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极区附近的颜色逐渐加深,这表明Fe(OH)3胶体粒子带正(填“正”或“负”)电荷.
(5)向(2)烧杯中的分散系中逐滴滴入过量的盐酸,会出现一系列变化:
①先出现红褐色沉淀,原因是Fe(OH)3胶体遇到电解质溶液,出现了胶体的聚沉.
②随后沉淀逐渐溶解,溶液呈棕黄色,反应的化学方程式为:Fe(OH)3+3HCl=FeCl3+3H2O.
分析 氧化铁和稀盐酸反应生成铁离子和水;
(1)FeCl3溶液滴入NaOH溶液,可观察到有红褐色沉淀生成,是氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠溶液,发生的是复分解反应;
(2)加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,液体为胶体分散系;
(3)胶体具有丁达尔现象,据此分析鉴别胶体;
(4)根据氢氧化铁胶体粒子带正电,则胶体具有电泳的性质来判断;
(5)①分散系中逐滴滴入过量的盐酸,先发生聚沉,先出现红褐色沉淀;
②随后沉淀逐渐溶解,溶液呈棕黄色,是氢氧化铁溶解生成氯化铁和水.
解答 解:氧化铁和稀盐酸反应生成铁离子和水,离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3+6H+═2Fe3++3H2O;
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,发生的反应为复分解反应,
故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;复分解反应;
(2)加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,液体为胶体分散系,
故答案为:红褐; Fe(OH)3胶体;
(3)检验胶体和溶液的方法是利用胶体有丁达尔现象分析,用激光笔照射,观察,有一条光亮的“通路”,
故答案为:用激光笔照射,观察,有一条光亮的“通路”;
(4)由于胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里作定向向阴极移动,阴极附近的颜色渐变深,这种现象叫电泳,
故答案为:阴;正;
(5)①先出现红褐色沉淀,原因是Fe(OH)3胶体遇到电解质溶液,出现了胶体的聚沉,
故答案为:Fe(OH)3胶体遇到电解质溶液,出现了胶体的聚沉;
②随后沉淀逐渐溶解,溶液呈棕黄色,是氢氧化铁溶解生成氯化铁和水,反应的化学方程式为:Fe(OH)3+3HCl=FeCl3+3H2O,
故答案为:Fe(OH)3+3HCl=FeCl3+3H2O.
点评 本题考查的是胶体的性质,难度中等,胶体的性质有:丁达尔效应、电泳、聚沉;利用丁达尔效应是区分胶体与溶液的一种常用物理方法.

| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 称量时,将放称量纸或烧杯中的称量物置于托盘天平的左盘,砝码放在托盘天平的右盘 |
I.维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物,我们所熟悉的维生素有A、B、C、D、E等.其中
(1)维生素C又称抗坏血酸,人体自身不能合成维生素C;
(2)上述五种维生素中,属于水溶性维生素的是维生素B、维生素C.
Ⅱ.下表是某品牌火腿肠包装上的部分说明.
| 品 名 | ××火腿肠 |
| 部分配料 | ①淀粉 ②味精 ③亚硝酸钠 ④精选瘦肉 |
| 保质期 | 0℃~4℃30天 |
| 生产日期 | 见封口 |
Ⅲ.请将下列食品或药品对应的序号填入相应空格处:
①胃舒平 ②阿司匹林 ③铁强化酱油 ④食用碘盐
(1)预防甲状腺肿大应补充④,
(2)预防贫血应补充③,
(3)感冒患者可服用②,
(4)胃酸过多患者可服用①.
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 分馏石油时,温度计的末端必须插入液面下 | |
| C. | 用分液漏斗分离环己烷和水的混合液体 | |
| D. | 用浓氨水洗涤做过银镜反应的试管 | |
| E. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |
| A. | 人类需要的蛋白质可由鸡蛋提供,多吃有益 | |
| B. | 为防止变胖,炒菜时不放油 | |
| C. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| D. | 淀粉、油脂、蛋白质为人体提供热能,只要这三种摄入量足够就可以 |
| A. | 食醋中乙酸含量为3~5g/100mL | B. | 与HCOOCH3互为同分异构体 | ||
| C. | 可用分液法分离乙酸和水 | D. | 能与碳酸钠溶液反应 |
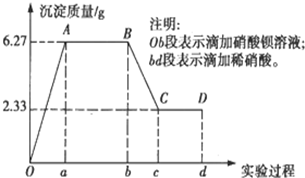 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:
