题目内容
6.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能到达试题目的是( )| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 蒸馏 |
| D | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、三溴苯酚均易溶于苯;
B.乙烯被高锰酸钾氧化后生成二氧化碳;
C.乙酸与碳酸钠反应后,与乙酸乙酯分层;
D.乙醇与水互溶,水与溴乙烷分层.
解答 解:A.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液除杂,故A错误;
B.乙烯被高锰酸钾氧化后生成二氧化碳,引入新杂质,应选溴水、洗气除杂,故B错误;
C.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可除杂,故C错误;
D.乙醇与水互溶,水与溴乙烷分层,则加水分液可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯方法等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.下列变化过程中肯定要放出热量的是( )
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | C(石墨)→C(金刚石) | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
14.利用下列实验装置进行的相应实验,能达到实验目的是(部分夹持仪器未画出)( )
| A. | 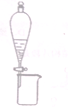 分离乙醇和乙酸乙酯 | |
| B. |  分离苯和甲苯 | |
| C. | 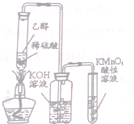 实验室制备,收集乙烯并验证其易被氧化 | |
| D. |  实验室制取乙酸乙酯 |
1.下列实验操作的描述中,正确的是( )
| A. | 从试剂瓶中取出的某些特殊药品,若有剩余可以放回原试剂瓶 | |
| B. | 配制一定质量分数的硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 称量NaOH固体时,在托盘天平的两个托盘上各放一张质量相同的滤纸,将NaOH固体放在左盘滤纸上称量 | |
| D. | 配制一定物质的量浓度溶液过程中,定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线 |
11.某水溶液只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-和SO42-.现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
| A. | 不-定存在K+ | B. | 100mL溶液中含有0.02molCO32- | ||
| C. | 可能存在Cl- | D. | 一定不存在Mg2+ |
18.下列反应中,不属于氧化还原反应的是( )
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | CaCO3+2HCl=CaCl2+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O=4NaOH+O2↑ | D. | Fe+CuSO4=FeSO4+Cu |
15.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe(OH)2.以下说法正确的是( )
| A. | 负极发生的反应为:Fe-2e-═Fe2+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 钢铁发生的是析氢腐蚀 | |
| D. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 |
16.下列电离方程式正确的是( )
| A. | HClO═H++ClO- | B. | HCO3?H++CO32- | ||
| C. | Ba(OH)2?Ba2++2OH- | D. | NaHCO3═Na++H++CO32- |
