题目内容
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
【答案】 > 不变 向正反应方向 1×10-12 1:10
【解析】试题分析:本题考查外界条件对化学平衡的影响,水的离子积的计算,酸碱混合溶液pH的计算。
(1)① 反应C(s)+H2O(g)![]() CO(g)+ H2(g)的特点是:正反应是气体分子数增大的反应。建立平衡过程中气体分子物质的量增大,平衡时气体分子物质的量大于起始物质的量;A为恒温恒容容器,建立平衡过程中A中气体压强增大,平衡时压强大于起始时压强;B为恒温恒压容器,建立平衡过程中B的体积增大,平衡时体积大于起始时体积;平衡时A中压强大于B中压强,B相当于在A达到平衡后减小压强,减小压强平衡向正反应方向移动,H2O的体积分数减小,V(A)%
CO(g)+ H2(g)的特点是:正反应是气体分子数增大的反应。建立平衡过程中气体分子物质的量增大,平衡时气体分子物质的量大于起始物质的量;A为恒温恒容容器,建立平衡过程中A中气体压强增大,平衡时压强大于起始时压强;B为恒温恒压容器,建立平衡过程中B的体积增大,平衡时体积大于起始时体积;平衡时A中压强大于B中压强,B相当于在A达到平衡后减小压强,减小压强平衡向正反应方向移动,H2O的体积分数减小,V(A)%![]() V(B)%。
V(B)%。
②A为恒温恒容容器,通入氦气,各物质的浓度不变,化学平衡不移动,A中H2O的转化率不变。B为恒温恒压容器,通入氦气,体积增大,相当于减小压强,平衡向正反应方向移动。
(2)0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,pH=10即c(H+)=1![]() 10-10mol/L,该温度下KW=c(H+)·c(OH-)=1
10-10mol/L,该温度下KW=c(H+)·c(OH-)=1![]() 10-10mol/L
10-10mol/L![]() 0.01mol/L=1
0.01mol/L=1![]() 10-12mol2·L-2。因为NaOH溶液与H2SO4溶液混合后溶液为中性,则NaOH溶液中的OH-物质的量等于H2SO4溶液中H+物质的量,
10-12mol2·L-2。因为NaOH溶液与H2SO4溶液混合后溶液为中性,则NaOH溶液中的OH-物质的量等于H2SO4溶液中H+物质的量, ![]() mol/L
mol/L![]() aL=1
aL=1![]() 10-2mol/L
10-2mol/L![]() bL,则a:b=1:10。
bL,则a:b=1:10。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】气体是物质聚集状态的重要形式之一,在实验室或工业上经常需制备气体。以下是某同学设计的实验室制备氨气的一些装置。
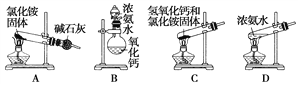
(1)上面是实验室制取氨气的装置和选用的试剂,其中不能得到氨气的是________(填字母)。
(2)利用装置B和下列提供的试剂,能制备的下列气体有________________(填气体的化学式)。
气体 | 所用试剂 |
SO2 | NaHSO3(固)+H2SO4(浓) |
Cl2 | MnO2(固)+HCl(浓) |
H2S | Na2S(固)+H2SO4(浓) |
O2 | Na2O2 (固)+H2O |
(3)实验室制备、收集干燥的NO2,所需仪器如图所示,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置D的作用是__________________________,装置E中盛放的溶液是________。制备时,烧瓶中装少量铜片,从分液漏斗向烧瓶中滴加浓硝酸,烧瓶中的现象是__________________________________________________________________。