题目内容
19.某化学实验小组的同学利用乙醇和浓硫酸制备乙烯气体并验证乙烯的某些化学性质.步骤如下:①在一蒸馏烧瓶中加入约20mL乙醇和浓硫酸(体积比为1:3),再加入少量的碎瓷片;
②瓶口插上带温度计的橡皮塞;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,分别通人酸性KMnO4溶液和溴水中.
据此回答下列问题:
(1)写出实验室制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在反应液中加入少量碎瓷片的作用是防止暴沸.
(3)步骤②中温度计水银球的正确位置是温度计水银球应浸没于反应混合液中.
(4)步骤③加热时,若反应温度不能迅速升高到170℃会产生一种有机副产物,写出该物质的名称乙醚.
(5)将乙烯(除杂后)通人酸性KMnO4溶液中,观察到的现象是溶液的紫红色退去; 通人溴水中发生反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br.
分析 实验室用浓硫酸做催化剂、脱水剂,加热到170度,使乙醇发生消去反应生成乙烯,反应中为防止发生爆沸,应加入几块碎瓷片,应控制混合液温度迅速升高到170度,否则容易生成副产物乙醚;
乙烯含有碳碳双键,能够被高锰酸钾氧化,使其褪色;能够与溴水发生加成反应,使其褪色.
解答 解:(1)乙醇在浓硫酸做催化剂、脱水剂条件下迅速加热到170吨发生消去反应生成乙烯,方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)为防止液体加热时发生爆沸现象,所以应加入几块碎瓷片,故答案为:防止暴沸;
(3)温度计测量的是浓硫酸乙醇的混合液温度,所以应该插入液面以下,故答案为:温度计水银球应浸没于反应混合液中;
(4)乙醇在浓硫酸催化剂、脱水剂作用下,加热到140度容易发生取代反应生成乙醚,故答案为:乙醚;
(5)乙烯含有碳碳双键,能够被酸性的高锰酸钾氧化,而使溶液的紫红色退去;乙烯能够与溴水中的溴发生加成反应而使溴水褪色,方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:溶液的紫红色退去;CH2=CH2+Br2→CH2Br-CH2Br;
点评 本题考查了乙烯的实验室制备和性质检验,熟悉制备原理是解题关键,注意实验中浓硫酸作用、温度计位置等,题目难度不大.

练习册系列答案
相关题目
14.7.4g某饱和一元醇X与足量金属Na反应,产生标准状况下H2 1.12L,则饱和一元醇X的可能结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.下列说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | C3H8的二氯代物共有3种 |
11.红辣椒中含有多种色泽鲜艳的天然色素,其中呈深红色的色素是辣椒红.依据下列结构简式判断,下列说法中正确的是( )
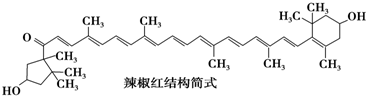

| A. | 不能发生氧化反应 | B. | 属于芳香族化合物 | ||
| C. | 能发生消去反应 | D. | 分子中含有11个碳碳双键 |
8.下列说法正确的是( )
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 红外光谱图的研究可以确定有机物的相对分子质量 | |
| C. | 测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的 | |
| D. | 铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素 |
9.下列说法错误的是( )
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 | |
| C. | 将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 | |
| D. | 用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
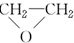 (环氧乙烷).
(环氧乙烷).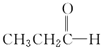 $\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH
$\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH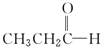 $→_{HCl}^{Zn(Hg)}$CH3CH2CH3
$→_{HCl}^{Zn(Hg)}$CH3CH2CH3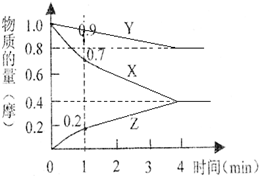 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.