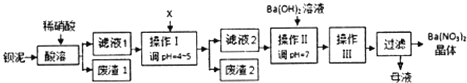
题目内容
7.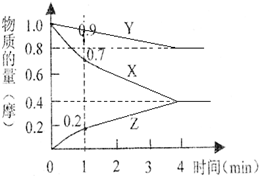 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.由图中数据分析,该反应的化学方程式为3X+Y?2Z,反应开始至1min,X的平均反应速率为0.15mol•L-1•min-1.若4min时反应达到最大限度,Z的物质的量等于0.4mol,此时,X的转化率为60%,Y的物质的量浓度为0.4mol•L-1.
分析 根据图片知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增大,说明X和Y是反应物、Z是生成物;反应到达平衡时,△n(X)=(1.0-0.4)mol=0.6mol,△n(Y)=(1.0-0.8)mol=0.2mol,△n(Z)=(0.4-0)mol=0.4mol,同一时间段内同一反应中,各物质的物质的量变化量之比与其计量数之比相等,从而确定反应方程式;
反应速率=$\frac{\frac{△n}{V}}{△t}$;
根据X和Z的关系式计算参加反应的X的物质的量,再根据转化率公式计算X的转化率;
物质的量浓度=$\frac{n}{V}$.
解答 解:根据图片知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增大,说明X和Y是反应物、Z是生成物;反应到达平衡时,△n(X)=(1.0-0.4)mol=0.6mol,△n(Y)=(1.0-0.8)mol=0.2mol,△n(Z)=(0.4-0)mol=0.4mol,同一时间段内同一反应中,各物质的物质的量变化量之比与其计量数之比相等=0.6mol:0.2mol:0.4mol=3:1:2,反应方程式为3X+Y?2Z;
从反应到1min时X的平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.0-0.7}{2}}{1}$ mol/(L•min)=0.15 mol/(L•min);
根据3X+Y?2Z知,Z的物质的量等于0.4mol,则参加反应的n(X)=1.5n(Z)=1.5×0.4mol=0.6mol,其转化率=$\frac{0.6mol}{1.0mol}×100%$=60%;
反应达到平衡状态时,剩余n(Y)=0.8mol,物质的量浓度=$\frac{n}{V}$=$\frac{0.8mol}{2L}$=0.4mol/L.
故答案为:3X+Y?2Z;0.15;60%;0.4.
点评 本题考查图象分析,正确从图象中获取信息、利用信息解答问题是解本题关键,注意该图象中只能得到反应方程式,不能得到三种物质的状态,为易错点.

 考前必练系列答案
考前必练系列答案| A. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| B. | 大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 石油的分馏、煤的气化、海水提溴的过程都包含化学变化 | |
| D. | 地淘油经处理后可作为汽车燃油,故地沟油的成分是液态烃 |
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
| A. | 新型催化剂 | B. | 新型农药 | ||
| C. | 半导体材料 | D. | 耐腐蚀的合金材料 |
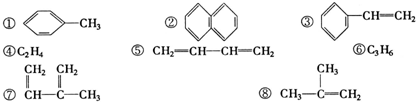
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑧ | D. | ④和⑧ |