题目内容
【题目】两同学为制得纯净的Fe(OH)2 , 使用如图所示的装置,A管中是Fe和H2SO4 , B管中是NaOH溶液: 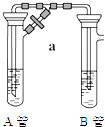
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 .
(2)同学乙:先打开a,使A管中反应一段时间后再夹紧止水夹a, 实验中在B管中观察到的现象是 .
B中发生反应的离子方程式为 .
【答案】
(1)有白色沉淀生成,迅速变成灰绿色,最终变成红褐色
(2)有白色沉淀生成;Fe2++2OH﹣=Fe(OH)2↓
【解析】解:(1)A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入B试管,B中反应为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 , Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3 , 所以现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 所以答案是:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色;(2)先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是有白色沉淀生成(且不变色),B中发生反应的离子方程式为:Fe2++2OH﹣=Fe(OH)2↓,所以答案是:有白色沉淀生成,Fe2++2OH﹣=Fe(OH)2↓.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目
