题目内容
2.下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.用元素符号来回答以下问题.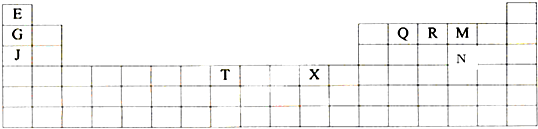
(1)X的核外电子排布式是:1s22s22p63s23p63d104s1.
(2)除了T、X两种元素外,余下的元素中,第一电离能最小的是Na.电负性最大的是F.
(3)下列有关上述元素的说法中,正确的是:③⑤(填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)T可形成+2和+3价的阳离子,其中较稳定的是Fe3+.原因:Fe2+的价电子排布式是3d6,Fe3+的价电子排布式是3d5,Fe3+的3d轨道处于半满状态,能量较低,Fe3+离子稳定
(5)R、M的氢化物较稳定的是H2O(填相应氢化物的化学式).M的单质在一定条件下可与R的氢化物反应生成R单质.请写出相关的化学方程式4NH3+3O2$\frac{\underline{\;一定条件\;}}{\;}$2N2+6H2O.
(6)QM2在水中的溶解度比NM2在水中的溶解度要小得多,其原因是:CO2属于极性分子,SO2属于极性分子,而水属于极性分子,相似相溶,CO2在水中溶解性比SO2在水中的溶解度要小得多.
分析 由元素在周期表中位置可知,E为H、G为Li、J为Na、T为Fe、X为Cu、Q为C、R为N、M为O、N为S.
(1)X为Cu,原子核外电子数为29,根据能量最低原理书写核外电子排布式;
(2)金属性越强,第一电离能越小,同周期自左而右电负性增大、同主族自上而下电负性减小;
(3)①G、J单质均为金属晶体,金属键越强,熔沸点越高;
②Na非常活泼,与溶液中水发生反应;
③将Na2O2溶于水生成氢氧化钠与氧气;
④NH3分子之间存在氢键,沸点高于CH4;
⑤C2H4分子含有4个C-H键、1个C=C双键,单键为σ键,双键含有1个σ键、1个π键;
(4)T为Fe元素,Fe2+的价电子排布式是3d6,Fe3+的价电子排布式是3d5,轨道处于全空、全满、半满状态时能量较低,离子稳定;
(5)非金属性越强,对应氢化物越稳定;氧气与氨气反应生成氮气与水;
(6)根据相似相溶原理分析解答.
解答 解:由元素在周期表中位置可知,E为H、G为Li、J为Na、T为Fe、X为Cu、Q为C、R为N、M为O、N为S.
(1)X为Cu,原子核外电子数为29,根据能量最低原理,其核外电子排布式为1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)除Fe、Cu外,Na的金属性最强,故Na第一电离能最小,同周期自左而右电负性增大、同主族自上而下电负性减小,故F元素电负性最大,故答案为:Na;F;
(3)①G、J单质均为金属晶体,锂离子半径小于钠离子半径,故Li的金属键更强,熔沸点高于钠,故正确;
②Na非常活泼,与溶液中水发生反应,不能置换出Cu,故错误;
③将Na2O2溶于水生成氢氧化钠与氧气,要破坏离子键和共价键,故正确;
④NH3分子之间存在氢键,沸点高于CH4,故错误
⑤C2H4分子含有4个C-H键、1个C=C双键,单键为σ键,双键含有1个σ键、1个π键,含有5个σ键、1个π键,故正确,
故答案为:③⑤;
(4)T为Fe元素,Fe2+的价电子排布式是3d6,Fe3+的价电子排布式是3d5,Fe3+的3d轨道处于半满状态,能量较低,Fe3+离子稳定,
故答案为:Fe3+;Fe2+的价电子排布式是3d6,Fe3+的价电子排布式是3d5,Fe3+的3d轨道处于半满状态,能量较低,Fe3+离子稳定;
(5)非金属性O>N,故氢化物稳定性H2O>NH3,氧气在一定条件下可与NH3反应生成氮气与,反应方程式为:4NH3+3O2$\frac{\underline{\;一定条件\;}}{\;}$2N2+6H2O,
故答案为:H2O;4NH3+3O2$\frac{\underline{\;一定条件\;}}{\;}$2N2+6H2O;
(6)CO2为直线型对称结构,属于极性分子,SO2中S原子价层电子对数为2+$\frac{6-2×2}{2}$=4,有2对孤电子对,属于V形结构,分子中正负电荷重心不重合,属于极性分子,而水属于极性分子,相似相溶,CO2在水中溶解性比SO2在水中的溶解度要小得多,
故答案为:CO2属于极性分子,SO2属于极性分子,而水属于极性分子,相似相溶,CO2在水中溶解性比SO2在水中的溶解度要小得多.
点评 本题是对物质结构的考查,涉及元素周期表与元素周期律、核外电子排布、电离能、电负性、晶体类型与性质、分子结构与性质等,需要学生具备扎实的基础,难度中等.

| A. | 增大反应物浓度,同时降低反应温度 | |
| B. | 增大压强同时使用催化剂 | |
| C. | 将反应混合物的用量同时增大一倍 | |
| D. | 升高温度同时将粉末状固体改为颗粒状固体 |
| 化合物/选项 | A | B | C | D |
| Y | H2O | Fe2O3 | C2H5OH | FeCl3 |
| W | Fe3O4 | Al2O3 | C2H5ONa | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
①液态水变成水蒸气
②酸碱中和反应
③金属钠与水的反应
④氧化钙与二氧化碳的反应
⑤H2在Cl2中燃烧
⑥熟石灰与氯化铵的反应.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
| A. | 是氢的一种新的同素异形体 | B. | 是氢的一种新的同位素 | ||
| C. | 它的组成可用H${\;}_{3}^{+}$表示 | D. | 它的化学性质与氢气相似 |
| A. | 3,4,4-三甲基己烷 | B. | 2,2-二甲基戊烷 | ||
| C. | 2-甲基-3-戊炔 | D. | 2-甲基-4-乙基戊烷 |
 ;
; .
.