题目内容
(11分)已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为: H2RO4=H++HRO4-;HRO4 H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿 (填“酸性”、“中性”或“碱性”),理由是__________ (用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-) 0.029 mol/L(填“<”、“>”或“=”),理由是 。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是 。
 H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿 (填“酸性”、“中性”或“碱性”),理由是__________ (用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-) 0.029 mol/L(填“<”、“>”或“=”),理由是 。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是 。
(11分)(1) 酸性 (1分) HRO4—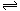 H++RO42—且HRO4—不水解(2分)
H++RO42—且HRO4—不水解(2分)
(2) 碱性(1分) RO42—+H2O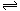 HRO4—+OH— (2分)
HRO4—+OH— (2分)
(3) < (1分) H2RO4第一步电离产生的H+抑制了第二步电离(2分)
(4) c(Na+) >c(HRO4—)>c(H+)>c(RO42-)>c(OH—) (2分)
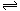 H++RO42—且HRO4—不水解(2分)
H++RO42—且HRO4—不水解(2分)(2) 碱性(1分) RO42—+H2O
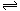 HRO4—+OH— (2分)
HRO4—+OH— (2分)(3) < (1分) H2RO4第一步电离产生的H+抑制了第二步电离(2分)
(4) c(Na+) >c(HRO4—)>c(H+)>c(RO42-)>c(OH—) (2分)
从电离方程式中可以,第一级电离全部电离,第二级部分电离,故NaHRO4溶液,只能电离不能水解。而Na2RO4溶液可以水解,呈碱性。(3)在H2RO4中,第一级电离出来的H+对第二级电离有抑制做用,故小于0.029mol/L。(4)NaHR04=Na++HRO,HRO H++ RO,故有c(Na+)>c(HRO)>c(H+)>c(RO)>c(OH—)
H++ RO,故有c(Na+)>c(HRO)>c(H+)>c(RO)>c(OH—)
 H++ RO,故有c(Na+)>c(HRO)>c(H+)>c(RO)>c(OH—)
H++ RO,故有c(Na+)>c(HRO)>c(H+)>c(RO)>c(OH—)
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

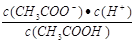 相等
相等