题目内容
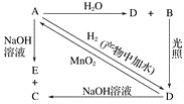
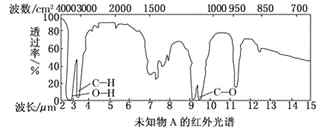
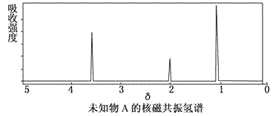
【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的价电子排布式_____________,基态Mn原子核外电子的运动状态有___种;
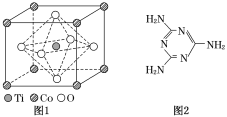
(2)①CoTiO3晶体结构模型如图1所示,晶胞参数a=0.53nm。在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
②列式表示CoTiO3晶体的密度:________g.cm-3(不必计算出结果,用NA表示阿伏加德罗常数的值)。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为___________、___________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是____________,1 mol三聚氰胺分子中σ键的数目为________。
【答案】3d54s225612(1×155)/[NA× (a×10-7)3]CO2(或N2O、CS2、BeCl2等合理均可)N![]() sp2、sp315NA
sp2、sp315NA
【解析】
(1)Mn为25号元素,根据电子排布规律可得电子排布式。
(2)观察CoTiO3晶体结构模型图,可知1个Ti原子周围距离最近的O原子数目分别为6个、1个Co原子周围距离最近的O原子数目为12个。
(3)等电子体为原子数目相等、价电子数相等。
(4)-NH2中N形成了三个单键为SP3杂化,环中N原子形成了一个单键和一个双键,为SP2杂化,1个三聚氰胺分子含15个σ键,所以1 mol三聚氰胺分子中 σ键的数目为15NA
(1)Mn是25号元素,其原子核外有25个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d54s2;每个电子都有1种运动状态,Mn原子核外有25个电子,所以共有25种运动状态。(2)①根据CoTiO3晶体结构模型图,在CoTiO3晶体中,1个Ti原子周围距离最近的O原子个数是6,1个Co原子周围距离最近的O原子数目=3×8÷2=12个;根据均摊原则,每个晶胞中Co原子数是![]() 、Ti原子数是1、O原子数是
、Ti原子数是1、O原子数是![]() ,晶胞的摩尔质量是155g/mol,一个晶胞的体积是a×10-7)3cm3,所以晶体的密度是(1×155)/[NA× (a×10-7)3] g.cm-3;(3)原子个数相等、价电子数相等的微粒互为等电子体,所以与CNO-互为等电子体的分子、离子化学式分别为CO2(或N2O、CS2、BeCl2等)、N3-;(4)氨基上N原子价层电子对个数是4,则N原子采用sp3杂化;环中N原子形成了一个单键和一个双键, N原子采用sp2杂化; 1个三聚氰胺分子中σ键个数是15,所以1mol三聚氰胺分子中σ键的数目为15NA。
,晶胞的摩尔质量是155g/mol,一个晶胞的体积是a×10-7)3cm3,所以晶体的密度是(1×155)/[NA× (a×10-7)3] g.cm-3;(3)原子个数相等、价电子数相等的微粒互为等电子体,所以与CNO-互为等电子体的分子、离子化学式分别为CO2(或N2O、CS2、BeCl2等)、N3-;(4)氨基上N原子价层电子对个数是4,则N原子采用sp3杂化;环中N原子形成了一个单键和一个双键, N原子采用sp2杂化; 1个三聚氰胺分子中σ键个数是15,所以1mol三聚氰胺分子中σ键的数目为15NA。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案