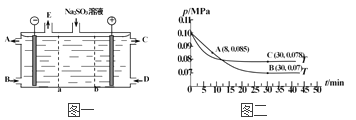
题目内容
【题目】常温下,Ksp[Mg(OH)2]=1.1×10-11, Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述不正确的是( )
A. 浓度均为2×10-5mol/L的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀生成
B. 将0.001mol/L的AgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CrO4混合溶液中,先产生AgCl沉淀
C. c(Mg2+)为0.11mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶液中c(Ag+)减少
【答案】A
【解析】A.Qc=c(Ag+)c(Cl-)=1×10-10<Ksp(AgCl)=1.8×10-10,没有氯化银生成,故A不正确;B. 浓度均为0.001mol/L的KCl和K2CrO4混合溶液中滴加AgNO3溶液,开始产生AgCl、Ag2CrO4时c(Ag+)分别是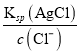 =1.8×10-7mol/L,(
=1.8×10-7mol/L,(![]() =(1.9×10-9
=(1.9×10-9![]() mol/L,AgCl需要的c(Ag+)较小,所以AgCl先析出,故B正确;C. c(OH-)>(
mol/L,AgCl需要的c(Ag+)较小,所以AgCl先析出,故B正确;C. c(OH-)>( 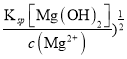 =1×10-5mol/L,溶液的pH要控制在9以上,故C正确;D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶度积不变,c(CrO42-)增大,c(Ag+)减少,故D正确。故选A。
=1×10-5mol/L,溶液的pH要控制在9以上,故C正确;D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶度积不变,c(CrO42-)增大,c(Ag+)减少,故D正确。故选A。

【题目】下图是元素周期表的一部分,根据元素在周期表中的位置回答下列问题,
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
⑦ | ⑧ | ⑨ | |||||||||||||||
⑩ | |||||||||||||||||
(1)元素⑤在周期表中的位置描述为____________,元素⑧的元素符号__________________。
(2)元素①~⑩的最高价氧化物的水化物中,碱性最强的是________________(填化学式)。
(3)元素②的单质的电子式______________,元素②的简单氢化物与其最高价氧化物的水化物反应,生成物中含有的化学键________________(填“离子键”、“极性键”或“非极性键”),元素①、②、③的简单氢化物的沸点由高到低的顺序是___________________(用化学式表示)。
(4)非金属性比较
a.装置1可用于比较元素①、②、⑤的非金属性强弱,则B中发生反应的离子方程式为:_______。
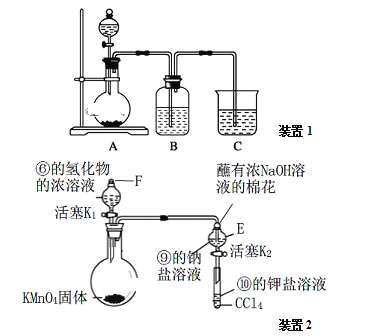
b.打开装置2中玻璃塞F和活塞K1,使液体滴入烧瓶中,待E中溶液颜色不再变化后,打开活塞K2,将E中溶液滴入小试管中,关闭活塞K2,取下小试管振荡,静置,下层液体呈现紫红色。上述实验_______(填“能”或“不能”)证明非金属性⑥>⑨>⑩。