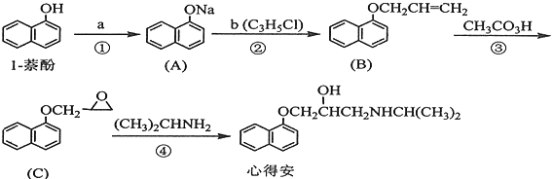
题目内容
【题目】已知A、B、C、D均为烃的衍生物,它们之间的转化关系如下图所示:

A俗称酒精;B是甲醛的同系物;C的分子式为C2H4O2。完成下列填空:
(1)A的结构简式为_________________;C的结构简式为_________________。
(2)下列能用来检验B的试剂为________________。(双选)
a.新制Cu(OH)2 b.银氨溶液 c.紫色石蕊试液
(3)D的名称为_______________;A与C反应生成D的反应类型为_______________。
(4)D与CH3CH2CH2COOH互为_______________。
a.同系物 b.同分异构体 c.同素异形体
【答案】CH3CH2OH CH3COOH a b 乙酸乙酯 取代反应 b
【解析】
B是甲醛的同系物,根据A为乙醇,氧化推出B为乙醛,乙醛又被氧化变为乙酸,C为乙酸,乙酸和乙醇发生酯化反应生成乙酸乙酯。
⑴A俗名酒精,其结构简式为CH3CH2OH,故答案为CH3CH2OH,C为乙酸,其结构简式为CH3COOH,故答案为CH3COOH;
⑵B为乙醛,检验乙醛的试剂是银氨溶液和新制氢氧化铜,故答案为a、b
⑶D是乙醇和乙酸发生酯化反应生成的乙酸乙酯,故答案为乙酸乙酯;A与C反应生成D的反应类型为取代反应(酯化反应),故答案为取代反应(酯化反应)。
⑷D为乙酸乙酯CH3COOCH2CH3,与CH3CH2CH2COOH分子式相同,结构式不同,互为同分异构体,故答案为b。

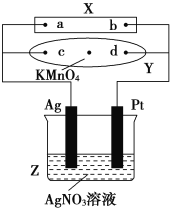
【题目】按图进行电解实验(A、B、C、D均为惰性电极),可供选择的电解质溶液列于下表中。要求满足的条件是:
①工作一段时间后甲中溶液的pH上升,乙中溶液的pH下降;
②B、C两极上放电的离子的物质的量相等。
甲 乙
组别 | ① | ② | ③ | ④ |
甲烧杯 | NaOH溶液 | NaCl溶液 | H2SO4溶液 | AgNO3溶液 |
乙烧杯 | CuSO4溶液 | AgNO3溶液 | AgNO3溶液 | CuCl2溶液 |
(1)应选择的电解质溶液是________组。
(2)电极反应式:B极______________________;D极___________________________。
(3)当B极上析出3.55g电解产物时,C极将析出______(填物质名称)的质量为______g。
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:
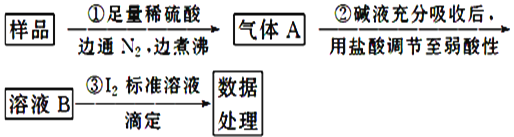
(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行查漏、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数 )。
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。
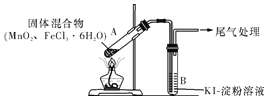
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。