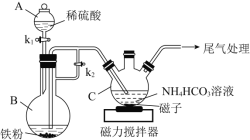
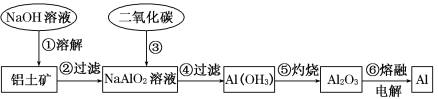
题目内容
【题目】已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目__________
(2)若生成448mL的NO(标准状况下),则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
【答案】 0.06
0.06 ![]()
【解析】
(1)反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
;硝酸、硝酸铜均拆成离子形式,剩余物质均不拆,离子方程式为:3Cu+8H+2NO3-=3Cu2++2NO ↑+4H2O;该反应中铜元素化合价升高,共失电子6个,根据电子得失守恒规律,硝酸根离子中氮原子得到6个电子,单纯桥法表示该反应电子得失的方向和数目如下: 。
。
故答案为: 。
。
(2). 448mLNO的物质的量为0.02mol,则该过程中转移的电子0.02mol×3=0.06mol.
故答案为:0.06。
(3)根据反应可知,8mol HNO3参加反应,被还原的硝酸有2mol,所以被还原的硝酸参与反应硝酸的比例为2/8=1/4。
故答案为:![]() 。
。

【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行查漏、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数 )。