题目内容
19.在某温度下,反应ClF(g)+F2(g)?ClF3(g)(正反应为放热反应)在密闭容器中达到平衡.下列说法正确的是( )| A. | 温度不变,缩小体积,ClF的转化率减小 | |
| B. | 温度不变,增大体积,ClF3的产率提高 | |
| C. | 升高温度,增大体积,平衡向正反应方向移动 | |
| D. | 降低温度,体积不变,F2的转化率升高 |
分析 该反应ClF(g)+F2(g)?ClF3(g)为正反应为放热的气体体积减小的反应,所以压强增大,平衡向气体体积减小的方向移动即正反应方向,升高温度,平衡向吸热的方向移动即逆反应方向,据此分析.
解答 解:A、缩小体积,压强增大,平衡向气体体积减小的方向移动即正反应方向,ClF的转化率增大,故A错误;
B、增大体积,压强减小,平衡向气体体积增大的方向移动即逆反应方向,ClF3的产率降低,故B错误;
C、升高温度,平衡向吸热的方向移动即逆反应方向;增大体积,压强减小,平衡向气体体积增大的方向移动即逆反应方向,所以升高温度,增大体积,有利于平衡向逆反应方向移动,故C错误;
D、降低温度,平衡向放热的方向移动即正反应方向,F2的转化率增大,故D正确;
故选:D.
点评 本题主要考查了外界条件对化学平衡的影响,掌握外界条件对化学平衡的影响是解题的关键.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
11.某羧酸酯的分子式为C10H18O3,1mol该酯完全水解可得到1mol羧酸和1mol乙醇,该羧酸的分子式为( )
| A. | C8H16O2 | B. | C8H16O3 | C. | C8H14O2 | D. | C8H14O3 |
10.以铝合金、Pt-Fe合金网为电极材料制成海水电池.下列关于这种电池的说法:①铝合金是阳极、②铝合金是负极、③海水是电解液、④铝合金电极发生还原反应,其中正确的是( )
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
7.下列装置能达到实验目的是( )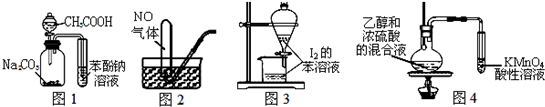

| A. | 图1证明酸性:CH3COOH>H2CO3>苯酚 | |
| B. | 图2用排水法收集NO | |
| C. | 图3萃取碘水中I2,分出水层后的操作 | |
| D. | 图4验证乙烯的生成 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═AlO2-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na:2 Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ |
8.已知H2SO4(aq)与Ba(OH)2(aq)反应的△H=-140.9kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol,则生成BaSO4(s)的反应热等于( )
| A. | -83.6kJ/mol | B. | -26.3kJ/mol | C. | 26.3kJ/mol | D. | 83.6kJ/mol |