题目内容
【题目】高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
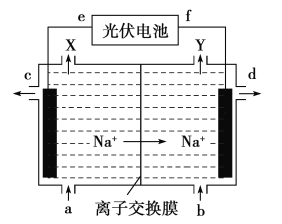
A. 上述装置中,f极为光伏电池的正极
B. 阴极的电极反应为2H2O-4e- =4H++O2↑
C. d处得到较浓的NaOH 溶液,c处得到HClO4
D. 若转移2mol电子,理论上生成100.5gHClO4
【答案】C
【解析】
A.电解池中阳离子向阴极移动,即d极为阴极,f为电源的负极,故A错误;
B.阴极上阳离子得到电子发生还原反应,故B错误;
C. 阳极的电极反应为2H2O-4e- =4H++O2↑,阴极电解方程式为:4H2O+4e-=4OH-+2H2↑,根据电极方程式可知,电池放电过程是电解水的过程,即在阳极水失去电子,所以在阳极得到高氯酸的浓溶液,在阴极得到浓的NaOH溶液,故C正确;
D.根据阴极电极方程式可知,转移2mol电子时,生成HClO42mol,理论上生成HClO4201g,故D错误;
故选C。

练习册系列答案
相关题目