题目内容
13.已知A为烃,B是烃的衍生物,由总物质的量为1mol的A和B组成的混合物在2.5mol氧气中完全燃烧,生成2mol二氧化碳和2mol水.A、B分子式不可能是下列组合中的( )| A. | CH4O、C3H4O | B. | C2H4、C2H4O2 | C. | C3H6O3、CH2O2 | D. | C2H2、C2H6 |
分析 根据混合物的物质的量、燃烧生成水和二氧化碳的物质的量确定混合物的平均C、H原子数,然后对各选项进行判断即可.
解答 解:1mol混合物完全燃烧生成2mol二氧化碳和2mol水,则A、B中平均C、H原子数为:N(C)=$\frac{2mol}{1mol}$=2、N(H)=$\frac{2mol×2}{1mol}$=4,
A.CH4O、C3H4O按照物质的量1:1混合时平均碳原子数为2,且满足平均氢原子数为4,二者符合条件,故A错误;
B.C2H4、C2H4O2的氢原子数都是4、碳原子数都是2,二者以任意比混合都满足条件,故B错误;
C.C3H6O3、CH2O2按照物质的量1:1混合时平均C、H原子数分别为2、4,满足条件,故C错误;
D.C2H2、C2H6中,B不是烃的衍生物,故D错误;
故选D.
点评 本题考查了混合物反应的计算、有机物分子式的确定,题目难度中等,根据质量守恒定律在确定有机物分子式为解答关键,注意掌握平均分子式在化学计算中的应用方法.

练习册系列答案
相关题目
16.硅橡胶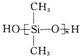 是由二甲基二氯硅烷
是由二甲基二氯硅烷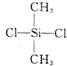 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )
 是由二甲基二氯硅烷
是由二甲基二氯硅烷 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )| A. | 消去反应、加聚反应 | B. | 水解反应、缩聚反应 | ||
| C. | 氧化反应、缩聚反应 | D. | 取代反应、加聚反应 |
4.下列说法中正确的是( )
| A. | O2与O3互为同位素 | |
| B. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| C. | 麦芽糖与蔗糖互为同分异构体 | |
| D. | CH3-CH2-CH2-CH3与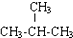 互为同系物 互为同系物 |
1.在元素周期表中,从左到右共有18个纵行.第1纵行(氢除外)为碱金属元素,稀有气体是第18纵行.下列说法中正确的是( )
| A. | 铝元素位于第3纵行,第ⅢA族 | |
| B. | 过渡元素在周期表中共占10个纵行,其中第Ⅷ族占8、9、10三个纵行 | |
| C. | 第17纵行都是非金属元素,所有元素的化合价都有+7价 | |
| D. | 第16纵行元素都是非金属元素 |
8.如图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式.
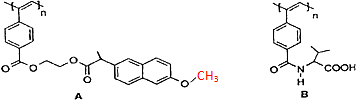
下列说法正确的是( )

下列说法正确的是( )
| A. | A和B均能在一定条件下水解,且水解均生成两种产物 | |
| B. | A水解生成的高分子化合物中所有碳原子一定共面 | |
| C. | A和B的链节中均含有2个以上手性碳原子 | |
| D. | 1molA和B各与热碱液反应,均最多消耗2n mol NaOH |
5.以元素化合价升降的观点分析下列各化学反应,其中不属于氧化还原反应的是( )
| A. | Mg+2HCl═MgCl2+H2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | CaCl2+Na2CO3═CaCO3↓+2NaCl |
2.下列有关叙述正确的是( )
| A. | 糖、油脂、蛋白质和纤维素都由碳、氢、氧元素组成,都是高分子化合物 | |
| B. | 糖、油脂、蛋白质和纤维素都能发生水解 | |
| C. | 葡萄糖和果糖、麦芽糖和蔗糖、淀粉和纤维素,它们间互为同分异构体 | |
| D. | 重金属盐能使蛋白质凝结,故误食重金属盐会中毒 |
3.下列说法正确的是( )
| A. | 乙酸乙酯的制备实验中,用饱和氢氧化钠溶液来吸收随乙酸乙酯蒸出的少量乙酸和乙醇 | |
| B. | 甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为不溶于水的油状液体 | |
| C. | 石油的蒸馏,温度计的水银球必须插入反应液液面以下 | |
| D. | 水与金属钠反应比乙醇与金属钠反应更剧烈 |

 .
. .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O.
+NaCl+H2O. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.