题目内容
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_____。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:_____。
(3)根据上述反应可推知_____。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)根据上述条件写出化学方程式,并用单线桥表示电子转移。__________。
【答案】AsH3 Br2 ac 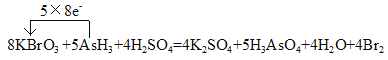
【解析】
(1)KBrO3在反应中得到电子,则还原剂应该在反应中失去电子,元素化合价升高,所以在反应物中元素价态低,分析给出的物质可知还原剂是AsH3,生成的氧化产物是H3AsO4;
(2)0.2molKBrO3在反应中得到1mol电子生成X,则Br元素化合价降低5价,由于在KBrO3中Br元素化合价为+5价,所以反应产生的X的价态为0,其化学式为Br2;
(3)在化学反应中,根据氧化剂:氧化剂>氧化产物;还原性:还原剂>还原产物。由于KBrO3将AsH3氧化为H3AsO4,KBrO3被还原为Br2,可知氧化性:KBrO3>H3AsO4,还原性:AsH3>Br2,所以选项ac合理;
(4)根据电子守恒、原子守恒,可得该反应的化学方程式为:8KBrO3+5AsH3+4H2SO4=4K2SO4 +5H3AsO4+4H2O+4Br2,As元素的化合价由反应前AsH3中的-3价变为反应后中的+5价,失去5×8e-;Br元素的化合价由反应前KBrO3中的+5价变为反应后Br2中的0价,得到8×5e-,用单线桥法表示电子转移为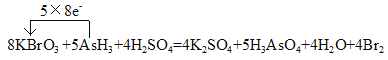 。
。

【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:________________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为__________。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)__________。三种元素电负性由大到小的顺序为(填元素符号)_____________。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)__________,原因是________________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:________________。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是________________。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O