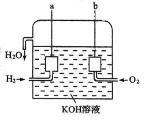
题目内容
【题目】久置的FeSO4溶液变黄,一般认为是被氧化为的缘故。回答下列问题:
(1)久置的FeSO4溶液中Fe3+的检验:
向久置的FeSO4溶液中加入KSCN的现象为:______________________________,向含有Fe3+久置的FeSO4溶液中加入少量KI—淀粉溶液,发现溶液变蓝,反应的离子方程式:________________________________________。
(2)除去久置FeSO4溶液中Fe3+:
在溶液中加入少量铁粉,可以观察到的现象为______________________;反应的离子方程式为:_____________________________,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因:__________________________。
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。
写出Fe(OH)2在空气中被氧化的化学方程式:________________________________,其现象为:__________________________________________________
(4)某研究小组研究常温下不同pH对Fe2+被O2氧化的影响,如图。结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响:___________________________________。
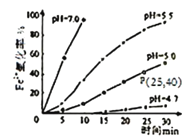
【答案】溶液变成血红色 2I-+2Fe3+=2Fe2++I2 溶液从黄色变为淡绿色 Fe+2Fe3+=3Fe2+ 会引入Cu2+新的杂质 4Fe(OH)2+O2+2H2O=4Fe(OH)3 白色沉淀迅速变为灰绿色,最终变为红褐色 在pH小于7的情况下,pH越大,反应速率越快。
【解析】
(1) 久置的FeSO4溶液中部分Fe2+被空气中的氧气氧化;Fe3+与作用KSCN变成血红色;Fe3+将I-氧化为I2;
(2)铁粉还原Fe3+而除去,溶液从黄色变为淡绿色;用铜粉作为除去FeSO4溶液中Fe3+会引入Cu2+新的杂质;
(3)Fe(OH)2在空气中被氧化生成Fe(OH)3;
(4)根据反应物的浓度越大,反应速率越快进行判断。
(1) 久置的FeSO4溶液中部分Fe2+被空气中的氧气氧化为Fe3+,向久置的FeSO4溶液中加入KSCN的现象为:溶液变成血红色,向含有Fe3+久置的FeSO4溶液中加入少量KI—淀粉溶液,发现溶液变蓝,Fe3+将I-氧化为I2,发生反应的离子方程式为:2I-+2Fe3+=2Fe2++I2;
(2)在溶液中加入少量铁粉,溶液中的Fe3+被铁粉还原为Fe2+,可以观察到的现象为溶液从黄色变为淡绿色;反应的离子方程式为:Fe+2Fe3+=3Fe2+,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因是:会引入Cu2+新的杂质;
(3)Fe(OH)2在空气中被氧化生成Fe(OH)3,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,其现象为:白色沉淀迅速变为灰绿色,最终变为红褐色;
(4)根据不同pH对Fe2+被O2氧化的关系图,可知pH越大,氧化速率越快,所以的氧化速率随pH增大而加快,故答案为:在pH小于7的情况下,pH越大,反应速率越快。