��Ŀ����
����Ŀ���������������գ���Ŀǰ����ˮ������������Ҫ����֮һ���乤���������£�
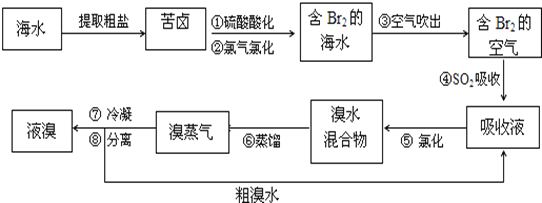
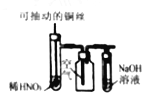
��1����������������ữ�����Cl2�������ʣ�������__________________________��
��2������ڷ�Ӧ�����ӷ���ʽΪ__________________________�������������SO2�Ļ�ԭ�ԣ���Ӧ�����ӷ���ʽΪ__________________________��
��3���������������У��¶�Ӧ������8090�档�¶ȹ�����Ͷ������������������ԭ��______________________��
��4���������������������õ�Һ������ˮ�Ļ������������ǵ�����ܶ����ܴ���ص���з��롣����������������__________________��
��5������١���֮��δֱ��������Br2�ĺ�ˮ����������õ�Һ�壬���Ǿ�������������������SO2�����������Ȼ���������������������������__________________________��
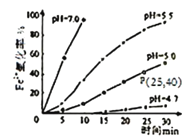
���𰸡��ữ���������������ˮ��Ӧ 2Br+Cl2=Br2+2Cl Br2+SO2+2H2O=4H++2Br-+SO42- �¶ȹ��ߣ�����ˮ������֮�ų���������ˮ�����ӣ��¶ȹ��ͣ��岻����ȫ���������ʵ� ��Һ©�� ������������SO2���ա��Ȼ����Ĺ���ʵ������һ��Br2��Ũ�����̣���ֱ������Br2��ˮ���Ч�ʸ��ߣ�������Դ�٣��ɱ�����
��������
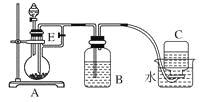
���������������ڹ�ҵ��ģ��ˮ����ij��÷���������һ�ֹ�������Ԥ�Ⱦ����ữ��Ũ����ˮ�У��������û�������ʹ֮��Ϊ�����壬�̶�ͨ�������ˮ���������崵����������ʹ�����������ռ���������������ת�����������Դﵽ������Ŀ�ģ�Ȼ�������������������õ���Ʒ�塣
(1)��������ˮ��ˮ������Ӧ��������ʹ����ᣬ�ữ���������������ˮ��Ӧ��
(2)��������������������������嵥�ʣ�����ʽΪ2Br+Cl2=Br2+2Cl����������嵥�ʽ�����������ˮ��Һ�����������ᣬ���ӷ���ʽΪBr2+SO2+2H2O=4H++2Br-+SO42-��
(3)����ˮ�У��¶ȹ��ߣ�����ˮ������֮�ų���������ˮ�����ӣ��¶ȹ��ͣ��岻����ȫ���������ʵͣ�
(4)��Һ������ˮ�����ܣ����÷�Һ©�����룻
(5)��ˮ�������ӵĺ������٣��ں�ˮ��ȡ��֮ǰ��������к�ˮŨ����������������SO2���ա��Ȼ����Ĺ���ʵ������һ��Br2��Ũ�����̣���ֱ������Br2��ˮ���Ч�ʸ��ߣ�������Դ�٣��ɱ����͡�

 �߽�������ϵ�д�
�߽�������ϵ�д�