题目内容
【题目】实验室欲制备FeCl3固体。已知FeCl3固体易吸水潮解。现利用下图装置制取FeCl3固体。
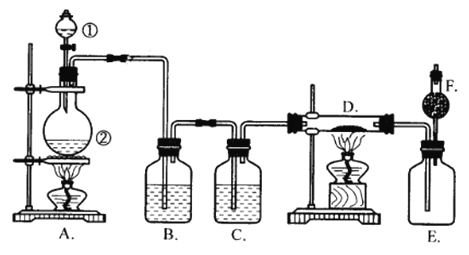
(1)分液漏斗①中放浓硫酸,烧瓶②中放固体氯化钠和二氧化锰,将浓硫酸滴加到烧瓶中共热。分两步写出反应的化学方程式:①_________________,②__________。
(2)为了获得纯净干燥的氯气,应除杂和干燥。在B瓶中的液体应是__________,其作用____________________;在C瓶中的液体应是________,其作用是________________。
(3)D中盛放的固体是铁粉,其中的反应方程式为___________________。在D及E装置中观察到现象是_________________________。
(4)F中装的是碱石灰(主要成分是CaO与NaOH),F的作用是_______。
【答案】 NaCl+H2SO4(浓)![]() NaHSO4+HCl↑; MnO2+4HCl(浓)
NaHSO4+HCl↑; MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 吸收HCl气体 浓H2SO4 吸收水蒸气 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 饱和食盐水 吸收HCl气体 浓H2SO4 吸收水蒸气 2Fe+3Cl2![]() 2FeCl3 有棕色的烟 吸收多余的Cl2,并防止空气中的水蒸气进入E与D中
2FeCl3 有棕色的烟 吸收多余的Cl2,并防止空气中的水蒸气进入E与D中
【解析】(1)浓硫酸与氯化钠反应生成氯化氢,氯化氢被二氧化锰氧化生成氯气,反应的方程式分别为NaCl+H2SO4(浓)![]() NaHSO4+HCl↑、MnO2+4HCl(浓)
NaHSO4+HCl↑、MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)生成的氯气中含有氯化氢和水蒸气,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,因此B瓶中的液体应是饱和食盐水,C瓶中的液体应是浓H2SO4;(3)氯气与铁在加热的条件下反应生成氯化铁,方程式为2Fe+3Cl2
MnCl2+Cl2↑+2H2O;(2)生成的氯气中含有氯化氢和水蒸气,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,因此B瓶中的液体应是饱和食盐水,C瓶中的液体应是浓H2SO4;(3)氯气与铁在加热的条件下反应生成氯化铁,方程式为2Fe+3Cl2![]() 2FeCl3,实验现象是产生棕色的烟;(4)氯气有毒,需要尾气处理,另外FeCl3固体易吸水潮解,所以F的作用是吸收多余的Cl2,并防止空气中的水蒸气进入E与D中。
2FeCl3,实验现象是产生棕色的烟;(4)氯气有毒,需要尾气处理,另外FeCl3固体易吸水潮解,所以F的作用是吸收多余的Cl2,并防止空气中的水蒸气进入E与D中。

 名校课堂系列答案
名校课堂系列答案【题目】将2molA和1molB充入VL的密闭容器中,在一定条件下发生反应:2A(g)+B(g)2C(g).平衡时C的体积分数(%)随温度和压强的变化如表所示:
压强/MPa | 1.0 | 2.0 | 3.0 |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
下列判断正确的是( )
A.b>e
B.415℃,2.0MPa时B的转化率为60%
C.该反应的△H>0
D.平衡常数K(550℃)>K(350℃)

