题目内容
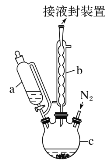
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器c的名称是______。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是______。
(2)步骤①中通入氮气的作用是_________。
(3)步骤⑤用盐酸洗涤的目的是_________。
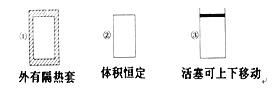
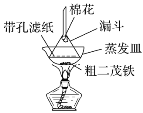
(4)步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为__________;为了确认得到的是二茂铁,还需要进行的一项简单实验是__________;
(5)若最终制得纯净的二茂铁4.3 g,则该实验的产率为________(保留小数点后一位)。
【答案】三颈烧瓶 平衡气压,有利于漏斗中的液体顺利流下 排尽装置中的空气,防止Fe2+被氧化 除去多余的KOH 升华 测定所得固体的熔点 58.4%
【解析】
根据仪器的结构确定仪器的名称,二茂铁中铁是+2价,易被空气中氧气氧化,据此分析通入氮气的目的,结合反应原理,分析三颈烧瓶中的剩余物得出盐酸洗涤的目的,根据环戊二烯计算二茂铁的理论产量,![]() ,以此计算。
,以此计算。
(1)根据仪器c的结构可知,c为三颈烧瓶,使用恒压滴液漏斗a可以平衡气压,有利于漏斗中的液体顺利流下,故答案为:三颈烧瓶;平衡气压,有利于漏斗中的液体顺利流下;
(2)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气可排尽装置中空气,防止实验过程中亚铁离子被氧化,故答案为:排尽装置中的空气,防止Fe2+被氧化;
(3)根据制备二茂铁的化学反应方程式,以及所给的KOH、氯化铁、环戊二烯的量,可知加入KOH应是过量的,因此步骤⑤中加入盐酸的目的是除去多余的KOH,故答案为:除去多余的KOH;
(4)根据已知信息,二茂铁在100℃时开始升华,再加上装置的示意图,蒸发皿上倒扣的漏斗,固体受热升华,再在漏斗上凝华,变成固体,为了确认是不是二茂铁,利用其物理或者化学性质,根据已知,二茂铁的熔点为173℃,可以测定其熔点,故答案为:升华;测定所得固体的熔点;
(5)环戊二烯的质量为5.5×0.95g=5.225g,FeCl2的质量为6.5g,根据反应方程式可知FeCl2过量,根据环戊二烯进行计算,理论上产生二茂铁的质量为![]() ,则产率为
,则产率为![]() ,故答案为:58.4%。
,故答案为:58.4%。