题目内容
5.现有如下某反应:M2O7n-+3RO32-+xH+=2M3++3RO42-+4H2O.请利用守恒法判断:x=8;n=2;M2O7n-中M的化合价为+6;R元素最可能为S.
分析 由M2O7n-+3RO32-+xH+=2M3++3RO42-+4H2O反应根据氢原子守恒计算x,根据电荷守恒计算n,再把n带入M2O7n-计算M2O7n-中M的化合价,根据化合价推断R.
解答 解:由M2O7n-+3RO32-+xH+=2M3++3RO42-+4H2O反应根据氢原子守恒,则x=8,根据电荷守恒8-n-3×2=2×3-3×2,解得n=2,所以M2O7n-为M2O72-,所以M的化合价为$\frac{2×7-2}{2}$=+6,R为短周期第ⅥA族,所以R元素最可能为S,故答案为:8;2;+6;S.
点评 本题考查氧化还原反应,侧重元素的价态和性质的考查,明确反应中元素的化合价变化即可解答,注意原子守恒计算x和利用电荷守恒得出n为解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列过程不需要通电就可以进行的是( )
| A. | 电离 | B. | 电解 | C. | 电镀 | D. | 电冶金 |
16.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g)?C(g)+D(g) 已达到平衡状态( )
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量.
A(s)+2B(g)?C(g)+D(g) 已达到平衡状态( )
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量.
| A. | ②③⑤ | B. | ①②③ | C. | ②③④ | D. | ①③④⑤ |
13.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法一定正确的是( )
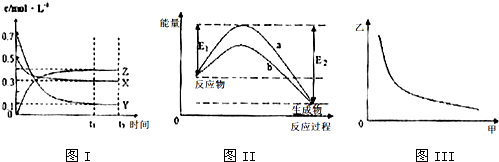

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=E2-E1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
20.下列对相关概念理解正确的是( )
| A. | 物质的量就是表示相关微粒的数量 | |
| B. | 物质的摩尔质量就是1mol该物质的质量 | |
| C. | 气体的摩尔体积都是22.4L/mol | |
| D. | 物质的量浓度表示单位体积的溶液中含有的该溶质的物质的量 |
10.蛋清的水溶液下列性质体现其是胶体的是( )
| A. | 能穿过滤纸 | B. | 烧焦产生焦羽毛气味 | ||
| C. | 具有丁达尔效应 | D. | 高于70℃发生变性 |
17.我国碘缺乏病病区人口约亿多,缼碘地区几乎覆盖全国,为此我国采用在食盐中添加含碘物质制成含碘食盐,该物质是( )
| A. | 碘酸钾 | B. | 碘化钾 | C. | 碘单质 | D. | 络合碘 |
14.碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的家用食盐都是“加碘食盐”.“加碘食盐”中的含碘元素的物质一般是( )
| A. | NaI | B. | KIO3 | C. | I2 | D. | AgI |
15.下列说法正确的是( )
| A. | 碰撞理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间有效碰撞的次数成正比 | |
| B. | 电解原理在生产中有着广泛的应用,工业上用电解熔融的氯化钠、氯化镁、氯化铝来冶炼Na、Mg、Al等活泼金属单质 | |
| C. | 盖斯定律表明,一个化学反应的焓变(△H)不仅与反应的起始和最终状态有关,还与反应的途径及过程有关 | |
| D. | 在工业生产中,研制出性能优良的催化剂可以使反应的温度降低,有效提高反应物的转化率,从而起到很好的节能效果 |