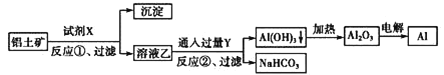
题目内容
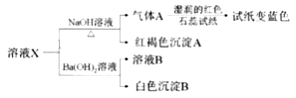
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
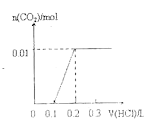
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
【答案】Ba(OH)2 2H++CO32-=H2O+CO2↑ NaHSO4 稀盐酸、BaCl2溶液 2H+ +BaCO32-=Ba2++H2O+CO2↑ ![]() ×100%
×100%
【解析】
可溶性物质A、B、C,C是碱,则C中含有OH-和Na+或Ba2+,碳酸钡和硫酸钡都是沉淀,所以C是Ba(OH)2;A、B是盐,且都是可溶性盐,A溶液与B溶液反应可生成气体X,则应该是硫酸氢钠和碳酸钠,A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸,则D应该是BaCO3,则A是Na2CO3,B是NaHSO4,E是BaSO4,据此分析解答。
可溶性物质A、B、C,C是碱,则C中含有OH-和Na+或Ba2+,碳酸钡和硫酸钡都是沉淀,所以C是Ba(OH)2;A、B是盐,且都是可溶性盐,A溶液与B溶液反应可生成气体X,则应该是硫酸氢钠和碳酸钠,A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸,则D应该是BaCO3,则A是Na2CO3,B是NaHSO4,E是BaSO4。
(1)通过以上分析,C是氢氧化钡,其化学式为Ba(OH)2,故答案为:Ba(OH)2;
(2)A是碳酸钠、B是硫酸氢钠,二者反应生成二氧化碳,所以X是CO2,离子方程式为2H++CO32-=H2O+CO2↑,故答案为:2H++CO32-=H2O+CO2↑;
(3)①通过以上分析知,B的化学式为NaHSO4 ,B中阴离子为硫酸根离子,其检验方法是先加稀盐酸除去其它离子干扰,然后再滴加氯化钡溶液,如果有白色沉淀生成,就说明含有硫酸根离子,故答案为:NaHSO4 ;稀盐酸、BaCl2溶液;
②D是碳酸钡,碳酸钡和稀硝酸反应生成硝酸钡、二氧化碳和水,离子方程式为2H++BaCO3=Ba2++H2O+CO2↑,故答案为:2H++BaCO3=Ba2++H2O+CO2↑;
③D是碳酸钡、E是硫酸钡,碳酸钡和稀盐酸反应,而硫酸钡和稀盐酸不反应,n(CO2)=![]() =
=![]() mol,根据C原子守恒得n(CO2)=n(BaCO3)=
mol,根据C原子守恒得n(CO2)=n(BaCO3)=![]() mol,则m(BaCO3)=
mol,则m(BaCO3)=![]() mol×197g/mol=
mol×197g/mol=![]() g,硫酸钡的质量=ag-
g,硫酸钡的质量=ag-![]() g,则硫酸钡在混合物中的质量分数的表达式为
g,则硫酸钡在混合物中的质量分数的表达式为 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________。
(3)“氧化”时,Fe2+被氧化的离子方程式为________。
(4)“滤渣2”的成分是______。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____;由浓缩液得到产品的步骤为____。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____%。