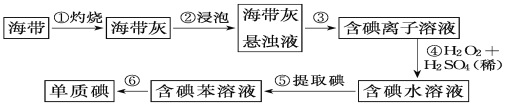
题目内容
【题目】已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大。B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素中原子半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍。请回答下列问题:
(1)画出F的原子结构示意图_______。
(2)B、C、E对应简单离子的半径由大到小的顺序为_________(用具体微粒符号表示)。
(3)A的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于_____(填“离子化合物”或“共价化合物”)。
(4)加热条件下,B单质与C单质的反应产物的电子式_____,该产物溶于水发生反应的化学方程式为______,立即向溶液中滴加酚酞溶液,观察到溶液的颜色变化情况为______。
(5)D的单质能与C元素最高价氧化物对应水化物的溶液反应生成无色气体,该反应的化学方程式为_________。
【答案】 S2>O2>Na+ 离子化合物
S2>O2>Na+ 离子化合物 ![]() 2Na2O2+2H2O=4NaOH+O2↑ 先变红后褪色 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Na2O2+2H2O=4NaOH+O2↑ 先变红后褪色 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,D是地壳中含量最多的金属元素,则D为Al,E、F原子序数均大于Al,处于第三周期,而E元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,故E为S元素,F为Cl;B和E同主族,则B为O元素;A、B(氧)在元素周期表中处于相邻的位置,A的原子序数小于B(氧),故A为N元素;C元素原子在同周期主族元素中原子半径最大,处于IA族,原子序数介于氧、铝之间,故C为Na,据此分析结合元素性质解答。
(1) F为Cl,位于第三周期,有三个电子层,最外层7个电子,原子结构示意图为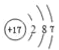 ;
;
(2) B为O元素,C为Na元素,E为S元素,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+;
(3) A为N元素,气态氢化物、最高价氧化物对应水化物分别为氨气、硝酸,二者反应生成硝酸铵,属于离子化合物;
(4)加热条件下氧气与钠的反应生成Na2O2,含有离子键、共价键,电子式为![]() ,Na2O2溶于水发生反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,立即向溶液中滴加酚酞溶液,由于生成氢氧化钠,溶液呈碱性,溶液颜色变红,过氧化钠具有强氧化性,可以漂白有色物质,溶液颜色又褪去,观察到溶液颜色:先变红后褪色;
,Na2O2溶于水发生反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,立即向溶液中滴加酚酞溶液,由于生成氢氧化钠,溶液呈碱性,溶液颜色变红,过氧化钠具有强氧化性,可以漂白有色物质,溶液颜色又褪去,观察到溶液颜色:先变红后褪色;
(5) D为Al,C为Na,Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

 阅读快车系列答案
阅读快车系列答案