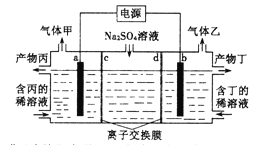
题目内容
【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
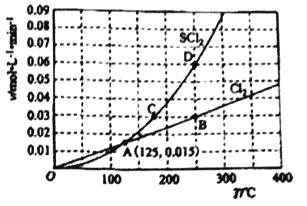
①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)
【答案】 0.02 mol·L-1 ·min-1 0.9mol·L-1 充入1.2molNO2(增大NO2浓度也可) < BD <
【解析】
(1)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,10min时到达平衡,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,因为NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;v(N2O4)=![]() =0.02mol.L-.min
=0.02mol.L-.min
平衡常数K=
c2(NO2) |
c(N2O4) |
=
0.62 |
0.4 |
=2.25,
因此,本题正确答案是:0,02 mol.L-.min;2.25;
②20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小,因此,本题正确答案是:增大NO2的浓度。
t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
③ C(NO2)=![]() =0.5mol/L C(N2O4)=
=0.5mol/L C(N2O4)=![]() =0.1mol/L Q=
=0.1mol/L Q=![]() =0.4<2,25,所以平衡向逆反应方向移动。所以v(正) <v(逆),故答案:<。
=0.4<2,25,所以平衡向逆反应方向移动。所以v(正) <v(逆),故答案:<。
(2)①根据反应II:S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;故达到平衡状态的有:B D。
2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;故达到平衡状态的有:B D。
② B、D点为平衡点,由图中数据可知,B、D点的状态对应的温度为250℃,300℃时,SCl2的消耗速率大于氯气的消耗速率的2倍,说明平衡逆向移动,则正反应为放热反应,ΔH2<0。正确答案:<。

【题目】市场销售的某种精制食用盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O,______________
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:_____________________________。
②某同学设计回收四氯化碳的操作步骤如下,请将缺少的操作步骤补充完整。
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3溶液
c.____________________ d.分离出下层液体。
(3)已知:I2+2S2O32=2I-+S4O62-。某质量检验监督局测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,以6.0×10-4mol·L-1的Na2S2O3标准溶液滴定,消耗20.00mL标准液。
①判断c中滴定反应恰好完全的现象是_____________________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是____mg/kg。
(4)用惰性电极电解KI溶液可制备碘酸钾,则阳极反应式为_____________________。