题目内容
某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表.
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”).铝片上的电极的反应式为 ;
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”),铝片为 极(填“正”或“负”).铜极上电极反应式为: ,正极上发生的电极反应式为 ;
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为 .
通过上述实验探究,你受到的启示是 .
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为
通过上述实验探究,你受到的启示是
分析:(1)该原电池中,铝易失电子作负极,铜作正极,电子从铝沿导线流向铜,电流计指针偏向失电子的电极;
(2)在浓硝酸中,铝被钝化,铜溶解,所以铜易失电子为负极,铝是正极,电流计指针偏向失电子的电极;
(3)在氢氧化钠溶液中镁不失去电子,而铝失去电子而作负极,镁作正极.
(2)在浓硝酸中,铝被钝化,铜溶解,所以铜易失电子为负极,铝是正极,电流计指针偏向失电子的电极;
(3)在氢氧化钠溶液中镁不失去电子,而铝失去电子而作负极,镁作正极.
解答:解(1)该原电池中,铝易失电子作负极,铜作正极,负极上铝失电子发生氧化反应,电极反应式为:2Al+6H+=2Al3++3H2↑,电流计指针偏向失电子的电极,所以电流计指针偏向铝,
故答案为:铝;2Al+6H+=2Al3++3H2↑;
(2)该原电池中,铝和浓硝酸发生钝化现象而阻止进一步反应,铜易和浓硝酸反应,所以铜易失电子而作负极,铝作正极,电流计指针偏向失电子的电极铜,铜电极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极上硝酸根离子得电子生成二氧化氮,电极反应式为:2NO3-+2e-+4H+=2NO2↑+2H2O,
故答案为:铜;正;Cu-2e-=Cu2+,2NO3-+2e-+4H+=2NO2↑+2H2O;
(3)该原电池中,铝易失电子而作负极,镁作正极,正极上水得电子生成氢氧根离子和氢气,电极反应式为:2H2O+2e-=2OH-+H2↑,
通过以上原电池可以得到以下启示:
1.电极类型与电解质溶液性质有关;2.金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;3.根据电极类型比较金属活泼性不一定正确;4.可以通过电流流向确定金属的相对活泼性.
故答案为:2H2O+2e-=2OH-+H2↑;1.电极类型与电解质溶液性质有关;2.金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;3.根据电极类型比较金属活泼性不一定正确;4.可以通过电流流向确定金属的相对活泼性.
故答案为:铝;2Al+6H+=2Al3++3H2↑;
(2)该原电池中,铝和浓硝酸发生钝化现象而阻止进一步反应,铜易和浓硝酸反应,所以铜易失电子而作负极,铝作正极,电流计指针偏向失电子的电极铜,铜电极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极上硝酸根离子得电子生成二氧化氮,电极反应式为:2NO3-+2e-+4H+=2NO2↑+2H2O,
故答案为:铜;正;Cu-2e-=Cu2+,2NO3-+2e-+4H+=2NO2↑+2H2O;
(3)该原电池中,铝易失电子而作负极,镁作正极,正极上水得电子生成氢氧根离子和氢气,电极反应式为:2H2O+2e-=2OH-+H2↑,
通过以上原电池可以得到以下启示:
1.电极类型与电解质溶液性质有关;2.金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;3.根据电极类型比较金属活泼性不一定正确;4.可以通过电流流向确定金属的相对活泼性.
故答案为:2H2O+2e-=2OH-+H2↑;1.电极类型与电解质溶液性质有关;2.金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;3.根据电极类型比较金属活泼性不一定正确;4.可以通过电流流向确定金属的相对活泼性.
点评:本题考查了原电池原理,注意原电池正负极的判断不能根据金属的活泼性强弱判断,要根据金属在电解质溶液中得失电子的难易程度判断,为易错点.

练习册系列答案
相关题目
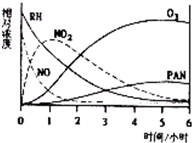 某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,下列推论最不合理的是( )
某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,下列推论最不合理的是( )