题目内容
【题目】(1)下图是氢氧燃料电池构造示意图。
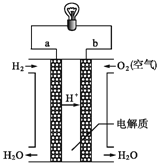
写出氢氧燃料电池的电极反应式:
负极:______________________________,正极:__________________________________。
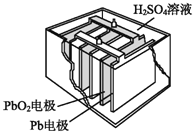
(2)汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。写出正极的电极反应式:_____________________。
【答案】H2—2e—=2H+ O2+4H++4e—=2H2O PbO2+4H++SO42—+2e—=PbSO4+2H2O
【解析】
(1)燃料电池中,一般燃料在负极发生反应,O2在正极发生反应;注意电解质溶液的酸碱性。
(2)原电池的正极发生还原反应。
(1)氢氧燃料电池中,H2在负极发生反应,电解质溶液为酸性,则H2+2e=2H+;O2在正极得到电子,和溶液中的H+结合生成水,方程式为O2+4e-+4H+=2H2O;
(2)正极发生的反应为还原反应,得到电子,化合价降低,分析化合价,得电子的为PbO2,生成PbSO4。方程式为PbO2+4H++SO42—+2e—=PbSO4+2H2O。

 口算题天天练系列答案
口算题天天练系列答案【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
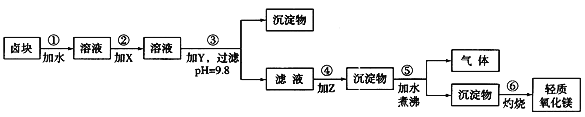
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6﹡ |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;
(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;/p>
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.86 | 1.10 | 0.99 | 1.52 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)⑥的单质在空气中加热,生成物的电子式为_______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________。
(3)比较①和⑦的氢化物的稳定性(用化学式表示)_______________________________。
(4)写出实验室制备⑤的单质的离子方程式:________________________________。
(5)写出⑧的单质跟③的最高价氧化物的水化物的溶液反应的离子方程式:___________________________。