题目内容
【题目】如图所示,在不同的电解质溶液中可以组成不同的电池.
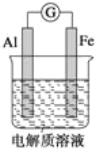
(1)当电解质溶液为稀硫酸时,Fe 电极是_____(填“正”或“负”)极,其电极反应式为______.
(2)当电解质溶液为 NaOH 溶液时,Al 电极是______(填“正”或“负”)极,其电极反应式为______.
(3)若把铝改为锌,电解质溶液为浓硝酸,则 Fe 电极的电极反应式为______.
【答案】正 2H++2e﹣═H2 ↑ 负 Al﹣3e﹣+4OH﹣═AlO2﹣+2H2 O NO3﹣+2H ++e﹣═NO2↑+H2O
【解析】
(1)①电解质溶液是稀硫酸时,Al电极是负极,Fe电极是正极;
②当电解质溶液是NaOH溶液时,铝与NaOH溶液反应,而Fe不反应,故铝作原电池的负极;
(2)把铝改为锌,用浓硝酸作电解质溶液,铁遇浓硝酸发生钝化,则Fe电极是正极,Zn电极是负极。
(1)①电解质溶液是稀硫酸时,Al电极是负极,Fe电极是正极,正极反应式为2H++2e﹣═H2 ↑;
②当电解质溶液是NaOH溶液时,铝与NaOH溶液反应,而Fe不反应,故铝作原电池的负极,电极反应式为Al﹣3e﹣+4OH﹣═AlO2﹣+2H2 O;
(2)把铝改为锌,用浓硝酸作电解质溶液,铁遇浓硝酸发生钝化,则Fe电极是正极;Zn电极是负极,Fe电极上的电极反应式为NO3﹣+2H ++e﹣═NO2↑+H2O。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
序号 | c(NO)/molL-1 | c(H2)/molL-1 | 速率/molL-1min-1 |
Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)·c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) △H=-664kJmol-1
【题目】下列实验操作能达到实验目的的是( )
选项 | 实验操作 | 实验目的 |
A | 加新制的Cu(OH)2并加热 | 确定尿液中含有葡萄糖 |
B | 滴加稀溴水 | 确定苯中混有甲苯 |
C | 加入金属钠 | 确定酒精中混有醋酸 |
D | 加淀粉 | 确定KCl中含有KI |
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氢氧化铝能与酸反应 | 用作抗酸药 |
C. | 明矾易溶于水 | 可作净水剂 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
