题目内容
【题目】石墨烯(图 a)是一种由单层碳原子构成的平面结构新型导电材料,具有大п共轭体系。石墨烯 中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石墨烯(图b)。
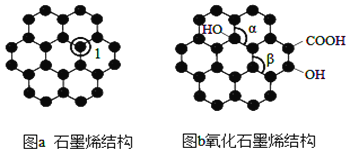
(1)图a中,1号C的杂化方式为______,石墨烯中含有的化学键类型是_____(填极性键,非极性键);图b中键角α____键角β(填“ >”、“<”或“=”),水分子的空间构型是____。
(2)基态钒原子的价电子排布式为______。
(3)醋酸铜可合成复合材料石墨烯![]() ,其制备原料为CuSO4、NH3·H2O和醋酸等。
,其制备原料为CuSO4、NH3·H2O和醋酸等。
①写出一种与SO42-互为等电子体的分子______。
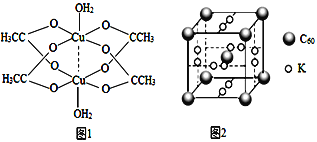
②二聚醋酸铜的结构示意图如图1所示,Cu2+的配位数为______。
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图2所示,晶胞边长参数为anm,该化合物中K原子和C60分子的个数比为_____,该晶体的密度ρ=_____ g.cm-3
【答案】sp2 非极性键 < V形 3d34s2 CCl4 5 3:1 ![]()
【解析】
根据图示原子间的成键方式分析原子的轨道杂化类型及共价键的极性;根据核外电子排布规律书写相关原子的电子排布式;根据等电子体原理及价层电子对互斥模型分析分子的空间构型及判断等电子体;根据配合物的组成及原理分析中心原子的配位数;根据晶胞结构计算晶胞密度。
(1)图a中,与1号C相连的C原子数为3,所以1号C与相邻C形成3个σ键,杂化方式为sp2;石墨烯中含有的化学键为非极性共价键;β角的中心碳是处在平面六边形中的,键角为120°,α角的中心碳周围连了4个单键,与甲烷的结构类似,键角小于120°,所以图b中键角α<键角β;水分子中氧原子轨道杂化类型为sp3,与H原子形成2个σ键,有两对孤电子对,所以分子空间构型为V形.
(2)V的原子序数为23,根据核外电子排布规律分析知基态钒原子的电子排布式为1s22s22p63s23p63d34s2,则价电子排布式为3d34s2。
(3)①等电子体是指价电子总数和原子总数相同的分子、离子或基团,SO42-共有32个价电子,5个原子,用“替代法”,CCl4或SiCl4中的价电子总数均为4+4×7=32,且都有5个原子,所以与SO42-互为等电子体。
②由图可知二聚醋酸铜中,有2个铜离子、2个水分子、4个醋酸根离子,则其化学式为Cu2(CH3COO)4(H2O)2,根据图示,Cu2+的配位数为5。
(4)如图所示,有12个K原子位于面上,则一个晶胞中K原子数为12×1/2=6,有8个C60位于顶点处、1个C60位于体心,则一个晶胞中C60分子数为8×1/8+1=2,该化合物中K原子和C60分子的个数比为6:2=3:1,一个晶胞的质量为![]() ,则该晶体的密度ρ=
,则该晶体的密度ρ=![]() g÷(a×10-7cm)3=
g÷(a×10-7cm)3=![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作、现象及结论均正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 黄色溶液中只含Br2 |
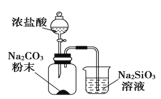
B | 烧杯中看见白色沉淀 | 证明酸性强弱:H2CO3>H2SiO3 |
C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
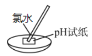
D | pH试纸先变红后褪色 | 氯水既有酸性,又有漂白性 |
A.AB.BC.CD.D