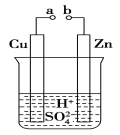
题目内容
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;![]() 的空间构型为 。(用文字描述)
的空间构型为 。(用文字描述)
(2)乙醇分子中氧原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)1mol[Cu(NH3)4]2+中σ键的数目为 。
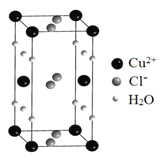
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。
【答案】(1)[Ar]3d9;正四面体
(2)sp3;H3O+
(3)16mol
(4)CuCl2·2H2O
【解析】
试题分析:(1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,Cu2+基态核外电子排布式为1s22s22p63s23p63d9;SO42-中的S原子杂化方式为sp3,所以SO42-的空间构型为正四面体型。
故答案为:1s22s22p63s23p63d9;正四面体;
(2)乙醇分子中O原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,氧原子杂化方式为sp3;
原子数目相等、价电子总数相等的微粒互为等电子体,与NH3互为等电子体的一种阳离子为H3O+。
故答案为:sp3;H3O+;
(3)在[Cu(NH3)4]2+中氨分子内氮氮原子和氢原子间是σ键、氨分子与铜离子间是配位键,所以1mol[Cu(NH3)4]2+中σ键的数目为16mol。
故答案为:16mol;
(4)晶胞中Cu2+离子数目为8×1/8+2×1/2=2、化合价代数和为0,则晶胞中Cl-离子数目为4,H2O数目为8×1/4+4×1/2=4,该物质化学式为:CuCl22H2O,
故答案为:CuCl22H2O

【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)= ;10 min时,改变的外界条件可能是 。
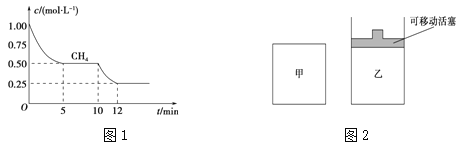
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
①可以判断甲容器中反应已达平衡状态的是 。
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 。
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)= P (乙)
(3)反应③中ΔH3= kJ·mol-1。800 ℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断