题目内容
下列物质的水溶液能导电,但属于非电解质的是
| A.H2SO4 | B.Cl2 | C.NaAlO2 | D.SO2 |
D
解析试题分析:H2SO4、NaAlO2都是电解质。Cl2是单质,既不是电解质,也不是非电解质。SO2+H2O=H2SO3,H2SO3 H++ HSO3-。水溶液能导电。故符合题意的物质是SO2选项为D.
H++ HSO3-。水溶液能导电。故符合题意的物质是SO2选项为D.
考点:考查电解质、非电解质等概念的知识。

练习册系列答案
相关题目
根据化学反应前后是否有离子参加或离子生成,可以将化学反应分为离子反应和非离子反应。下列化学反应中不属于置换反应但属于离子反应的是( )
A.CO+CuO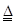 Cu+CO2 Cu+CO2 |
| B.2Na+2H2O=2NaOH+H2↑ |
| C.Fe+CuSO4=FeSO4+Cu |
| D.2FeCl3+Cu=2FeCl2+CuCl2 |
下列离子在碱性溶液中能大量共存,并且溶液为无色透明的是
A.Na+、Cu2+、SO 、OH― 、OH― | B.K+、Ba2+、Cl―、NO3― |
| C.Na+、Cl―、Ca2+、MnO4― | D.Na+、HCO3―、SO42―、Cl― |
下列能正确表示相应过程的离子方程式的是( )
| A.纯碱显碱性的原因:CO32-+ 2 H2O = H2CO3 + 2 OH- |
B.稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3 kJ/mol,则稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式表示为: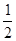 H2SO4(l)+ KOH(l) = H2SO4(l)+ KOH(l) = 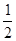 K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol |
| C.明矾溶液中滴加氢氧化钡溶液至沉淀的物质的量最大: 2 Al3+ +3 SO42-+3 Ba2+ +6 OH- =" 2" Al(OH)3 ↓+ 3 BaSO4 ↓ |
D.铜和浓硫酸混合加热:2H2SO4(浓)+Cu SO2↑+Cu2+ +SO42-+2 H2O SO2↑+Cu2+ +SO42-+2 H2O |
滴加新制氯水后,下列各组离子可能大量存在的是
| A.Fe3+、Cl-、NO3- | B.Na+、HCO3-、SO42- |
| C.Ag+、NH4+、NO3- | D.Na+、SO32-、SO42- |
碱性溶液中能大量共存且溶液为无色透明的离子组是 ( )
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、H+、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42- |
常温下,下列各组离子一定能大量共存的是
| A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- |
| B.[H+]=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| C.[OH-]/ [H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- |
| D.由水电离的[H+]=1.0×10-13 mol·L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
下列各组离子中,在碱性溶液中能共存,且加入硫酸过程中会产生气体和沉淀的是
| A.K+、Na+、AlO2-、CO32- | B.Na+、Cl-、SiO32-、K+ |
| C.Na+、NO3-、AlO2-、K+ | D.Na+、Cl-、HCO3-、Ba2+ |
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是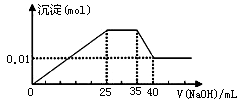
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
| D.实验所加的NaOH的浓度为2mol·L-1 |